生体内の老化細胞を除去する新規治療ワクチン
糖尿病モデルマウスで治療効果を確認
研究成果のポイント
・老化細胞 を生体から除去する治療ワクチンの開発に成功
・マウスの脂肪組織の老化T細胞を減らすことで、糖尿病マウスの高血糖が改善
・ワクチンと一緒に投与するアジュバントの使い分けで、細胞除去ワクチンの作製が可能となった
概要
大阪大学大学院医学系研究科の中神啓徳寄附講座教授(健康発達医学)、吉田翔太医員(老年・総合内科学)、楽木宏実教授(老年・総合内科学)、森下竜一寄附講座教授(臨床遺伝子治療学)らの研究グループは、老化T細胞除去を目的とした治療ワクチンを作製し、糖尿病モデルマウスに投与した結果、老化T細胞を減らすことによる病態の改善効果が得られたことを明らかにしました。
老化T細胞は加齢とともに増加して、いろいろな病気の進展に関与することが分かっています。(図1)に示すように、マウスに高脂肪食を負荷して肥満にさせると内臓脂肪で老化T細胞(PD-1陽性/CD153陽性細胞)が増えてきます。このマウスにCD153を標的としたペプチドワクチンを投与したところ、老化T細胞の増加が抑えられることが分かりました。同時にこの老化T細胞数を減少させたマウスは糖尿病が改善していることが分かりました。
老化細胞は加齢に伴ういろいろな病気の原因となっていることが報告されていますが、本研究はワクチンによって老化細胞数を減らすことに成功した世界初の報告となります。
なお、本研究成果はNature Communicationの電子版に5月19日に掲載されました。
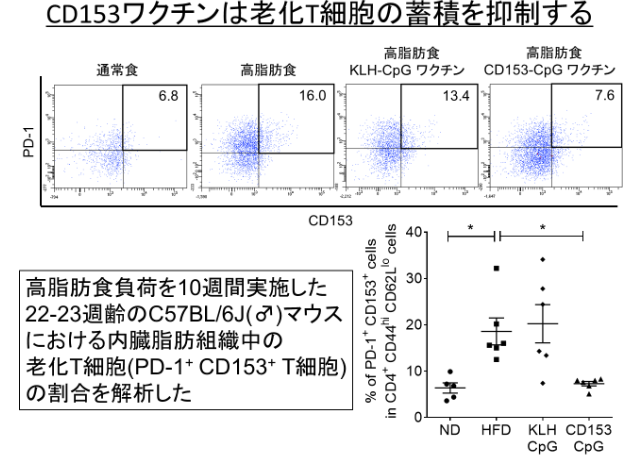
図1 FACSを用いたマウス内臓脂肪に存在する老化T細胞の解析
老化細胞はPD-1陽性・CD153陽性です。通常食で飼育したマウスの内臓脂肪と比べ、高脂肪食で飼育したマウスの内臓脂肪での老化T細胞は6.8%から16.0%に増加した。高脂肪食で飼育したマウスにCD153ワクチンを投与しておくと、7.6%まで増加が抑えられた。
研究の背景
(老化とSASP)
培養細胞を継続して観察を続けると、細胞が死滅しないまま増えなくなることが知られており、細胞老化(Cellular Senescence)と言われています。細胞に様々なストレスがかかりDNA損傷が蓄積することによって、Senescenceが促進されることが明らかとなっています。近年、この老化細胞から炎症性サイトカインなどが多量に分泌されることで、周辺の細胞に悪影響を及ぼし細胞老化を促進している現象が報告され、SASP(senescence-associated secretary phenotype:老化関連分泌現象)と命名されています。遺伝子改変マウスでこの老化細胞を生体から除去するモデルマウスを作成した結果、寿命の延長と加齢に伴う様々な症状が抑制できたことから、老化細胞を除去することによる抗老化治療の概念(senolysis)が提唱されています。現在、様々な手法を用いて世界中で老化細胞除去治療法が開発されています。
(細胞除去ワクチンの仕組み)
中神寄附講座教授らの研究グループは、生活習慣病・難治性疾患を標的とした抗体産生誘導を主眼とした治療ワクチンの研究開発を行ってきました。今回、治療ワクチンの新しい試みとして、細胞除去を目的としたワクチン開発に挑戦しました。
本研究の成果
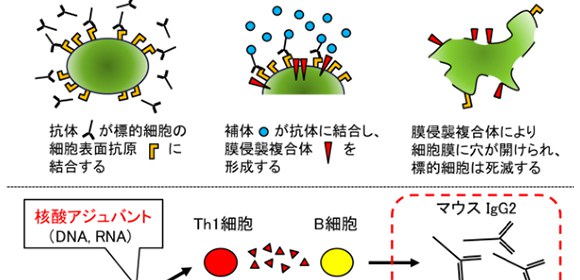
ワクチンによる免疫応答は細胞性免疫 と液性免疫 の2種類に大別されますが、本研究グループが開発したワクチンでは細胞性免疫を立ち上げることなく、液性免疫だけを活性化し抗体産生を誘導することが特徴です。また、抗体も主として中和活性を有する抗体産生を目指すために、誘導するIgGサブクラス としてはADCC(抗体依存性細胞傷害)やCDC(補体依存性細胞傷害)などのエフェクター機能を有しないIgG2(マウスではIgG1)の産生が望ましく、Th2活性を高めるタイプのアジュバント であるアラム等を用いてきました。
一方で、膜タンパクなどを抗原として治療ワクチンを設計し、逆にCDC活性を有するIgG1(マウスではIgG2)抗体を主として誘導することにより、標的細胞(今回は老化細胞)に傷害を与え生体から除去することが可能であることが分かりました。
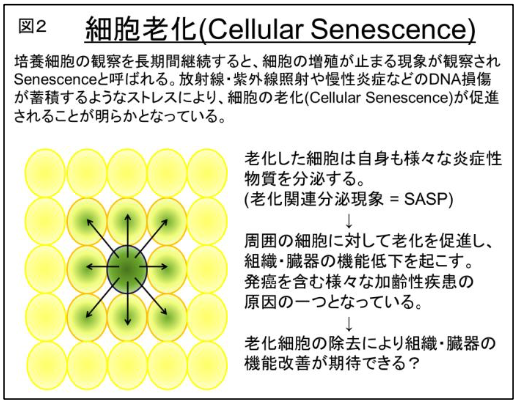
図2 細胞老化(Cellular Senescence)
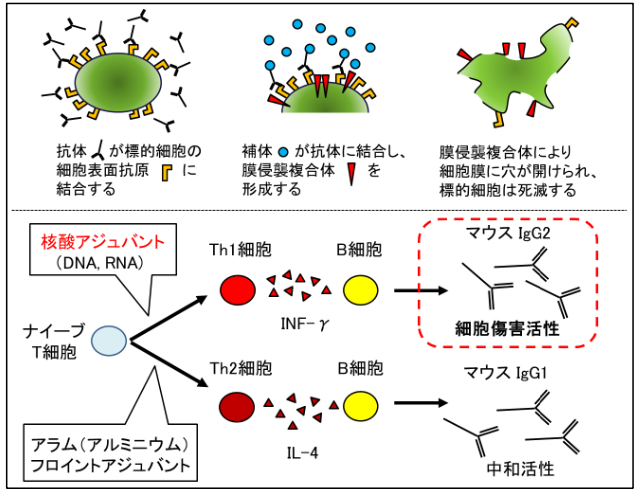
図3
上段(CDC補体依存性細胞傷害):抗体が細胞表面の抗原と結合した後に補体を呼び寄せて複合体を形成する。この複合体が細胞膜に穴をあけることで細胞傷害を与え、細胞が死滅する。
下段(IgGサブクラスによる機能の違い):アジュバントのタイプによりワクチンで誘導されるIgGサブクラスが変わり、細胞傷害活性の強さを調整することができる。
本研究では、治療標的細胞として老化T細胞(SenescentTcell)を標的とし、その表面分子CD153を認識する抗体をワクチン投与によって産生させたところ、核酸アジュバントを用いてマウスIgG2の産生を高めることにより老化T細胞を効率よく除去できることが分かりました。
老化T細胞除去による糖尿病治療
マウスに高脂肪食を与えることで肥満・糖尿病となることが知られていますが、増えた脂肪の中に老化T細胞が多く増えていることが分かりました。そこに、CD153を標的としたワクチンを投与しておくと、脂肪での老化T細胞の増加が抑制できることが分かりました。そこで、ワクチンを投与しながらマウスに高脂肪食を与えていき、細胞除去が出来たワクチンと出来なかったワクチンで耐糖能を比較してみたところ、糖負荷試験において老化細胞を除去したマウスの方が血糖が低いという結果が得られました。また、脂肪での炎症の起点となるマクロファージの浸潤も抑制されていました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究は世界中で開発が進んでいる老化細胞除去治療(Senolysis)の治療ツールとして、ワクチンを用いた世界初の研究成果であり、これまで感染症予防やがん治療に主として用いられてきたワクチンの新しい適応の可能性を示したものです。本治療ワクチンの細胞殺傷能力はそれほど強くはありませんが、がん細胞や細菌・ウイルスに対して老化細胞の数はそれほど多くなく、しかも慢性的な進行であるため、研究グループのコンセプトである抗体を主とした産生誘導により、ゆっくりと持続的な効果を目指す治療標的としては最適であると考えられます。
老化T細胞は糖尿病だけでなく様々な老化関連疾患への関与が考えられるため、臓器別の治療法でなく複数の疾患にまたがった治療法としての可能性も考えられます。
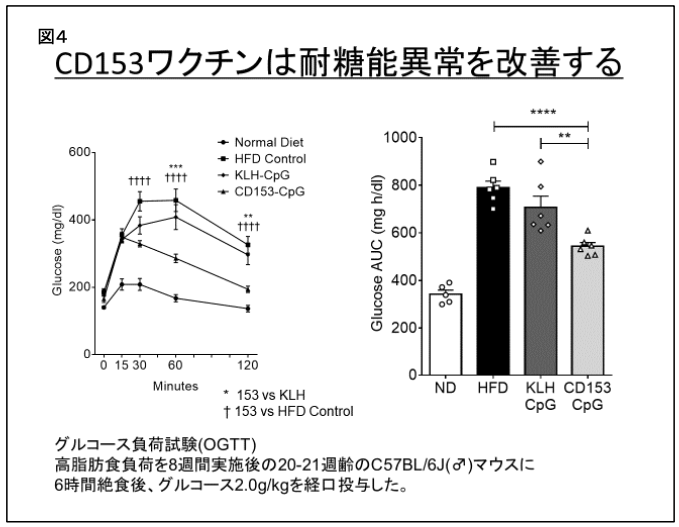
図4 CD153ワクチンは耐糖能異常を改善する
特記事項
本研究成果は、2020年5月19に海外科学誌「Nature Communications」(オンライン)に掲載されました。
【タイトル】“The CD153 vaccine is a senotherapeutic option for preventing the accumulation of senescent T cells in mice”
【著者名】Shota Yoshida, 1,2 Hironori Nakagami, 2 * Hiroki Hayashi, 2 Yuka Ikeda, 3 Jiao Sun, 2 Akiko Tenma, 3 Hideki Tomioka, 3 Tomohiro Kawano, 2,4 Munehisa Shimamura, 2 Ryuichi Morishita, 5 Hiromi Rakugi, 1 (*責任著者)
【所属】
1. 大阪大学 大学院医学系研究科 老年・総合内科学
2. 大阪大学 大学院医学系研究科 健康発達医学
3. ファンペップ株式会社
4. 大阪大学 大学院医学系研究科 神経内科学
5. 大阪大学 大学院医学系研究科 臨床遺伝子治療学
なお、本研究は、日本学術振興会科学研究費補助金の一環として行われました。
参考URL
大学院医学系研究科 健康発達医学 http://www.cgt.med.osaka-u.ac.jp/vme/index.html
用語説明
- 老化細胞
老化細胞は、分裂を停止して増殖しない状態にあり、Senescenceと言われている。近年、この老化細胞から炎症性サイトカインなどが多量に分泌され、周辺の細胞に悪影響を及ぼし細胞老化を促進している現象が報告され、SASP(senescence-associated secretary phenotype:老化関連分泌現象)と命名されている。
- アジュバント
アジュバントとは、薬物による効果を高めたり補助したりする目的で併用される物質・成分の総称。抗原抗体反応を活性化させる非特異的免疫賦活剤。核酸アジュバント(DNA, RNA, CpG)はTh1細胞が誘導するサイトカインにより細胞傷害性機能を活性化させる。一方で、アラム(アルミニウム)などのアジュバントはTh2細胞が誘導するサイトカインにより細胞傷害性の低い中和抗体の活性を誘導することが知られている。
- 細胞性免疫
病原体に感染した異常細胞を攻撃・排除するために、細胞傷害性T細胞やマクロファージが直接細胞を攻撃する免疫反応。ヘルパーT細胞である「Th1細胞」が、樹状細胞が提示する抗原を認識して、サイトカインを産生し、そのサイトカインによって、マクロファージ、細胞傷害性T細胞などが活性化される。
- 液性免疫
B細胞と抗体が中心となる免疫反応。ヘルパーT細胞「Th2細胞」の産生するサイトカインにより、B細胞が刺激されると、大量の抗体を産生する。
- IgGサブクラス
ヒトやマウスには4つのIgGサブクラス(IgG1, 2, 3, 4)がある。ヒトではIgG1が、補体系の活性化作用が強く60-65%を占める。一方、ヒトIgG2は20-25%を占め、補体系の活性化作用は低い。
- ADCC(抗体依存性細胞傷害)やCDC(補体依存性細胞傷害)
ADCCは標的細胞に特異抗体が結合し,その抗体にマクロファージやNK(ナチュラルキラー)細胞が結合して引き起こされる標的細胞の細胞傷害・細胞死。CDCは同様に抗体が細胞表面の抗原と結合した後に補体を呼び寄せて複合体を形成し、細胞膜に穴をあけることで細胞傷害を与え、細胞を死滅させる。
