がん細胞が血管網に似た構造を造る仕組みを解明
がん増殖の鍵となる細胞間の“力”の発見
研究成果のポイント
・がん細胞は、生体内で血管網に似たネットワーク構造を造ることが知られていたが、試験管内で再現することは困難だった。
・がん細胞をマトリゲル 上で培養することで、ネットワーク構造を造り出すことに成功した。
・シミュレーション を使った解析を行い、がん細胞の集団がネットワーク構造を形成するためには、離れた細胞の間に働く遠隔力と、接触した細胞の間のみに働く接触力が重要であることを明らかにした。
・がん増殖・浸潤・転移の仕組みの理解や、新たな仕組みの抗がん剤の開発につながると期待
概要
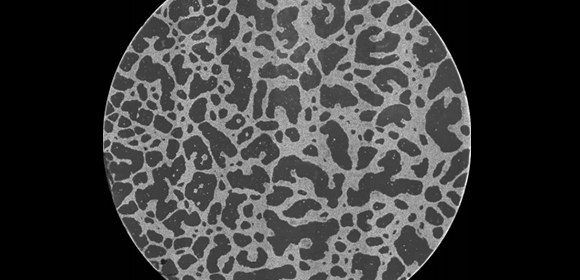
大阪大学データビリティフロンティア機構の中野賢特任准教授(常勤)の研究グループは、大阪大学大学院生命機能研究科平岡泰教授の研究グループおよび国立研究開発法人情報通信研究機構原口徳子主任研究員の研究グループとの共同研究で、がん細胞の集団が自己集合して血管網に似たネットワーク構造を形成することを、試験管内で再現することに成功しました (図1) 。さらに、単純な個体ベースモデル に基づくシミュレーションを用いて、細胞間に働く力がネットワーク構造の形成に重要であることを発見しました。
これまでがん細胞は、生体の中で、自ら血管網に似た構造(血管様構造)を造り出すことで、血液を取り入れ増殖を続けると考えられていましたが、その仕組みについては理解されていませんでした。
今回、中野特任准教授(常勤)らの研究グループは、マトリゲル上で細胞を培養したときに得られたがん細胞集団の動きを、シミュレーションを使って再現することにより、がん細胞がネットワーク構造を形成するためには、離れた細胞の間に働く遠隔力と、接触した細胞の間のみに働く接触力の二つの力が重要であることを発見しました。この成果により、がんの増殖・浸潤・転移の仕組みの理解や、これら二つの力をコントロールすることでネットワーク構造の形成を抑制する、新たな仕組みの抗がん剤の開発につながることが期待されます。
本研究成果は、米国科学誌「Biophysical Journal」に、3月25日(水)に掲載されました(オンライン版は2月4日に公開済み)。

図1 およそ10万個のがん細胞が試験管内に形成したネットワーク構造(顕微鏡写真)
円領域の直径は14mm
研究の背景
がん細胞が生体内で増殖を続けるためには、栄養を継続的に獲得する必要があります。そのためがん細胞は、血管の伸長を促す信号分子を分泌して、血管、すなわち、栄養源を自らの方向に引き寄せることが知られています。さらに驚くべきことに、がん細胞自身が血管網に似たネットワーク構造を形成して、血管に協調的にアクセスしたり、得られた栄養をがん細胞の間で循環させたりすることが最近の研究から示唆されています。しかし、がん細胞が形成するネットワーク構造を試験管内で再現することは難しく、がん細胞による構造形成の仕組みは理解されていませんでした。
本研究では、マトリゲルの上でがん細胞を培養することで、がん細胞の集団が自己集合し、ネットワーク構造を形成することを発見しました。この時の、個々のがん細胞の動きを、顕微鏡を使って観察したところ、がん細胞がネットワーク構造を形成するためには、細胞間に働く二種類の力が重要であることが分かりました。一つ目の力は、離れた細胞の間に働く力で、本研究では「遠隔力」と名付けました。まるで二つの物体が万有引力によって引き寄せられるように、物理的に離れている二個のがん細胞が互いの方向に移動することがありました。この力の作用を受けて細胞集団は細胞密度が高い方向に移動して集合体を形成することを確認しました (図2) 。もう一つの力は、物理的に接触した細胞の間のみに働く力で、本研究では「接触力」と名付けました。がん細胞は細胞密度が高い方向に移動する傾向が強いのですが、必ずしもそうではなく、物理的に接触している細胞の方向に動くことがありました (図3) 。遠隔力によって細胞の集合体が形成されると同時に、接触力によって集合体同士が連結される結果、特徴的なネットワーク構造が造り出されることが分かりました。
研究グループは、遠隔力と接触力を考慮した単純な個体ベースモデルを用いて、がん細胞が様々な構造を形成する過程 (図4) を再現できないかと考えました。この個体ベースモデルでは、10万個程度の細胞の各々を一つの個体と考え、遠隔力と接触力に基づく単純な法則に従って動かしました。任意の二つの細胞の間には遠隔力が働き、接触している細胞の間には接触力も働きます。二種類の力を導入したシミュレーションでは、実験結果を忠実に再現できました (図5) 。一方、一種類の力を使ったシミュレーションでは、実験結果をうまく再現できませんでした。この結果から、がん細胞による構造形成において遠隔力と接触力の両方が重要であることが分かりました。本研究の成果は、細胞間に遠隔力や接触力が働いていると考えることによって、複雑な生命現象を簡単に理解することに成功したこととも言えます。
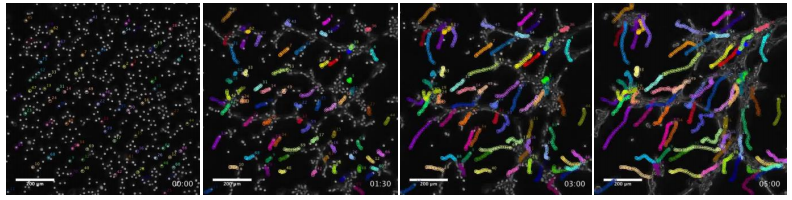
図2 がん細胞の集団移動と集合(顕微鏡写真)
左側の写真は実験の初期状態を写している。およそ700個のがん細胞が存在。残り3枚の写真では、適当に選んだ71個のがん細胞が5時間の間に移動した軌跡を示している。多くのがん細胞が中央よりやや右上の辺りに向かって移動し、集合体を形成した。物理的に離れた細胞が同じ方向に移動しており、遠隔力の存在を示唆する。各正方形領域の大きさは、1mmx1mm。
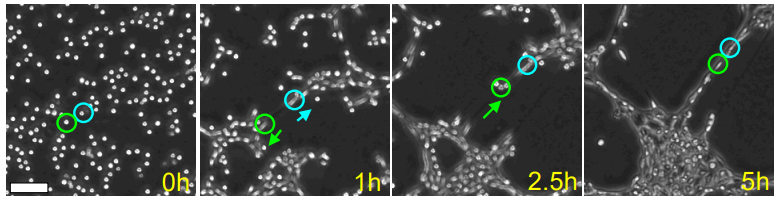
図3 がん細胞集団がネットワーク構造を形成する過程(顕微鏡写真)
緑色の円で囲んだ細胞は、初めに左下の方向に移動するが(0~1時間)、その後、青色の円で囲んだ細胞の方向に伸展する(2.5~5時間)。その結果、左下の集合体と右上の集合体を結ぶ「架け橋」となる。緑色の円で囲んだ細胞は物理的に接触している青色の円で囲んだ細胞の方向に移動しており(2.5~5時間)、接触力の存在を示唆する。各正方形領域の大きさは、0.5mmx0.5mm。

図4 がん細胞集団が形成する構造(顕微鏡写真)
がん細胞集団は、細胞密度が低い場合、孤立した「離島」を所々に形成する。細胞密度が高い場合、隙間の少ない「大陸」を形成する。その間細胞密度で、特徴的なネットワーク構造を形成する。各円領域の直径は14mm。

図5 シミュレーションの結果
がん細胞集団が初期密度に依存して種々の構造を形成する現象をシミュレーションで再現
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、がんの増殖に必要な血管様構造を形成するときの仕組みの一端が明らかになりました。この成果により、がん増殖・浸潤・転移の仕組みの理解につながると共に、細胞間に働く力をコントロールする薬剤の開発は、新規の抗がん剤の開発につながると期待されます。
特記事項
本研究成果は、2020年3月25日(水)に米国科学誌「Biophysical Journal」に掲載されました(オンライン版は2月4日に公開済み)。
タイトル:“Roles of Remote and Contact Forces in Epithelial Cell Structure Formation”
著者名:Tadashi Nakano (1), Yutaka Okaie (1), Yasuha Kinugasa (2), Takako Koujin (3), Tatsuya Suda (4), Yasushi Hiraoka (2,3), and Tokuko Haraguchi (2,3)
(1)大阪大学データビリティフロンティア機構
(2)大阪大学大学院生命機能研究科
(3)国立研究開発法人情報通信研究機構 未来ICT研究所
(4)University Netgroup Inc.
なお、本研究は、日本学術振興会科学研究費補助金基盤A(中野賢)「分子通信技術の国際標準化と医療応用」、同基盤A(平岡泰)、同基盤B(原口徳子)などの一環として行われました。
参考URL
大阪大学 データビリティフロンティア機構 分子通信工学研究室
http://www.fbs.osaka-u.ac.jp/labs/tadashi_nakano/index.html
用語説明
- マトリゲル
細胞を3次元培養するために開発されたゲル状の物質。細胞外マトリクスの商品名。基底膜に含まれるラミニン分子やコラーゲンなどを含む。神経細胞や血管内皮細胞などの足場を要する細胞の分化や、運動性などを観察することができるとされている。血管内皮細胞は、マトリゲル上では、血管構造に見られるような管腔構造を形成する。
- シミュレーション
対象となるシステムで働いている支配的な法則を見つけて、数理モデルなどを作成し、コンピュータを使って、対象となるシステムの動作を再現したり、予測したりする方法。
- 個体ベースモデル
システムを構成する個体に着目したモデリング手法。個体の動作や個体間の相互作用をモデル化する。各個体が単純な法則に基づいて動作する場合でも、多数の個体がそれぞれ局所的に相互作用する結果、システム全体が複雑に動作することがある。複雑な現象を理解する際に有効なモデリング手法。
