22番目の染色体欠失による指定難病「22q11.2欠失症候群」に糖代謝制御異常が関与する可能性を発見
研究成果のポイント
・22番目の染色体の一部が欠損することで発症する指定難病「22q11.2欠失症候群」 において、原因候補遺伝子CRKLおよびCRK遺伝子ファミリーの欠損が関与し、代謝制御異常を引き起こす可能性を見出した。
・オミクス解析 を用いたデータ駆動型研究 手法により、中心糖代謝系 の低下が明らかになった。
・本成果により、22q11.2欠失症候群および類似した症候群の診断と治療に、将来、糖代謝に注目した臨床応用が期待できる。
概要
大阪大学蛋白質研究所 細胞システム研究室(岡田眞里子教授 (兼:国立研究開発法人 医薬基盤・健康・栄養研究所 (NIBIOHN) 細胞ネットワーク制御プロジェクト・プロジェクトリーダー、理化学研究所 生命医科学研究センター 統合細胞システム研究チーム・チームリーダー))、米国シカゴ大学ベン・メイがん研究所(Akira Imamoto 准教授)、理化学研究所生命医科学研究センター 統合細胞システム研究チーム(奇世媛テクニカルスタッフ(旧所属))、慶應義塾大学先端生命科学研究所(福田真嗣特任教授)、東京大学大学院新領域創成科学研究科(鈴木穣教授)、東京工業大学生命理工学院らの国際共同研究グループは、指定難病のひとつで重篤な先天性障害をきたす22q11.2欠失症候群に糖代謝制御異常が関与する可能性をはじめて明らかにしました。22q11.2欠失症候群はヒト染色体22番q11.2の一部欠損により、心疾患、免疫不全、腎泌尿器疾患などの重篤な先天性障害をきたすことが知られています。しかし、この疾患の詳細な発症機構の全容は明らかになっておらず、確固とした治療の手がかりは見出されていませんでした。
大阪大学およびシカゴ大学らの本研究グループは、22q11.2欠失症候群の発症機序 (図1) を明らかにするため、これまで本疾患の解析に用いてきた解剖学的あるいは生化学的な実験手法に加えて、本疾患のモデルマウスであるCRKおよびCRKL遺伝子欠損マウスから得た細胞に存在する分子を網羅的に同定し、情報学的に解析する、オミクス解析といったデータ駆動型研究手法を新しく取り入れました。この手法により得られた代謝関連遺伝子や代謝物の変化と細胞を用いた検証実験 (図2) により、これまで全く予想することができなかった糖代謝異常と本疾患の関わりが明らかになりました。本成果は、糖代謝制御の改善を通した、22q11.2欠失症候群の新しい治療法の開発につながることが期待されます。
本研究成果は、国際科学誌『Life Science Alliance』に、2月10日(月)午後11時(日本時間)に公開されました。
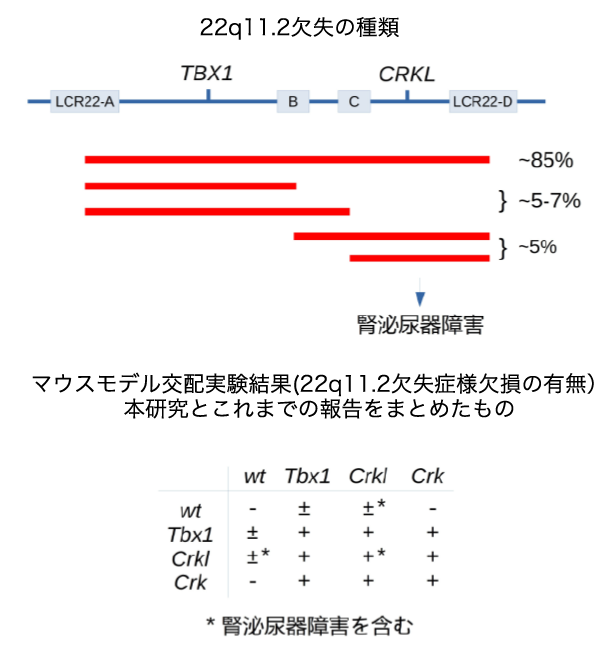
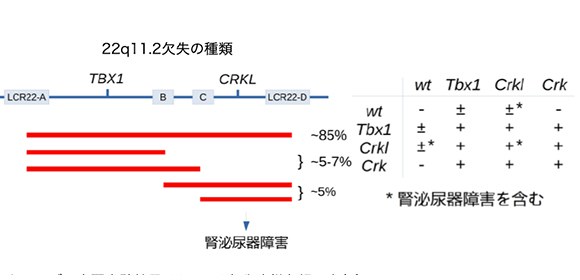
図1 22q11.2欠失の多様性と遺伝子の関係
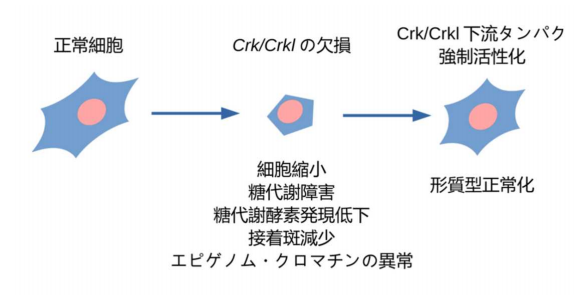
図2 本研究により観察されたCrk/Crkl欠損による細胞形態変化と代謝の変化
図3 22q11.2欠失症候群に見られる形態異常
研究の背景および内容
22q11.2欠失症候群は、ヒト染色体22番q11.2の一部欠損により、心疾患、免疫不全、腎泌尿器疾患などのさまざまな重篤な先天性障害をきたすことが報告されています。この疾患は指定難病のひとつで、染色体の微小欠失から起こる症候群としては最も頻度が高く、最近の推定では、1000胎児当たり約一個体の頻度で発見されていますが、新生児では3000-6000個体のうち一人の頻度とされています。これまでの研究より、22q11.2欠失染色体領域に存在する遺伝子のうちTBX1が発症に最も重要な疾患候補遺伝子として考えられてきましたが、染色体欠失領域がTBX1を含まない患者も多く存在し、また、症候群としての重篤度なども個体差が非常に大きいため、複雑な発症機序がかかわっていることが予想されていました。
本研究で注目したCRKおよびCRKL遺伝子は、ともに、シグナル伝達系と呼ばれる環境と細胞内の遺伝子調節や代謝などを制御する生化学反応を司る蛋白質をコードし、細胞増殖、形態制御、代謝、免疫応答など、さまざまな疾患との関係が報告されています。これまで、シカゴ大のImamotoらは、マウスをモデルとした実験を行い、CRKLが22q11.2欠失症候群の候補遺伝子であり、CRKLの欠失が胎生期に心血管形成を含む神経堤細胞由来の臓器の異常を引き起こすことをはじめて報告しています。また、22q11.2欠失症候群の症状のうちの、少なくとも、腎泌尿器疾患にはTBX1ではなくCRKLが関与する可能性が高いことがImamotoらを含む多数の研究室の共同研究により報告されています。
本研究では、マウスの遺伝子交配実験により、22q11.2欠失症候群の原因遺伝子候補の一つであるCRKLとその同じ遺伝子ファミリーに属するCRKの欠損がそれぞれ、22q11.2欠失症候群のもう一つの原因遺伝子候補として知られるTBX1の欠損と同時に起こることにより、より重篤なマウスの心形成異常が引き起こされることを明らかにしました。また、CRKは染色体22q11上の遺伝子ではないにもかかわらず、CRKLまたはCRKのそれぞれの遺伝子単独のホモ欠損、CRK/CRKLの共ヘテロ欠損をマウスに引き起こすと、22q11.2欠失症候群に似た形態異常を示しました。このことから、CRKLとCRKの機能の共通部分が、この症候群で異常の起きる胎生期の発生過程に重要であることが示唆されました。CRKおよびCRKLは、ともに、シグナル伝達系と呼ばれる環境と細胞内の遺伝子調節や代謝などを制御する生化学反応を司る蛋白質として知られています。このことから、この遺伝子欠損マウスから得た細胞を使い、全遺伝子発現プロファイリング、エピゲノム、メタボローム解析などを含めた、多種類のオミクス解析によるデータ駆動型研究の手法を用いて、この2つの蛋白質の機能の共通部分を探索したところ、中心糖代謝系の低下といった異常が見られることを発見しました。さらに、糖代謝の抑制薬剤が、CRK/CRKL欠損細胞の生存率を悪化させること、また、それとは逆に、CRK/CRKL制御下の蛋白質を活性化させることにより、糖代謝障害を含むCRK/CRKL欠損細胞の形態を回復できたことから、22q11.2欠失症候群の発症機序の少なくとも一部は、中心糖代謝障害によるものと推測されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、22q11.2欠失症候群の発症機序の少なくとも一部には、糖代謝障害が関わる可能性が示されました。本成果は、胎生期の栄養などのコントロールにより、糖代謝制御の改善を通した、22q11.2欠失症候群の新しい治療法の開発につながることが期待されます。
特記事項
本研究成果は、2020年2月10日(月)午後11時(日本時間)に国際科学誌『Life Science Alliance』(オンライン)に掲載されます。
タイトル:“Essential role of the Crk family-dosage in DiGeorge-like anomaly and metabolic homeostasis”
著者:Akira Imamoto, Sewon Ki, Leiming Li, Kazunari Iwamoto, Venkat Maruthamuthu, John Devany, Ocean Lu, Tomomi Kanazawa, Suxiang Zhang, Takuji Yamada, Akiyoshi Hirayama, Shinji Fukuda, Yutaka Suzuki, and Mariko Okada
掲載雑誌:Life Science Alliance(ライフサイエンスアライアンス)
なお、本研究は、文部科学省科学研究費 新学術研究(研究領域提案型)「代謝統合オミクス」、同研究費基盤(A)「疾病機序理解のための遺伝子ネットワーク数理モデル基盤の構築」等の支援を得て、行われました。
参考URL
大阪大学 蛋白質研究所 細胞システム研究室
http://www.protein.osaka-u.ac.jp/cell_systems/index_ja.html
用語説明
- 22q11.2欠失症候群
22q11.2欠失症候群は、ヒト染色体22番q11.2の一部欠損により、心疾患、免疫不全、腎泌尿器疾患などのさまざまな重篤な先天性障害をきたすことが報告されています。染色体の微小欠失から起こる症候群としては最も頻度が高く、最近の推定では、1000胎児当たり約一個体の頻度で発見されていますが、新生児では3000-6000個体のうち一人の頻度とされています。これまでの研究より、22q11.2欠失染色体領域に存在する遺伝子のうちTBX1が発症に最も重要な疾患候補遺伝子として考えられてきましたが、染色体欠失領域がTBX1を含まない患者もかなり多く存在し、また、症候群としての重篤度なども個体差が非常に大きいため、複雑な発症機序がかかわっていることが予想されていました。また、22q11.2欠失症候群と非常によく似た先天性障害をきたすことで知られているDiGeorge症候群(DGS)、口蓋心臓顔面症候群(VCFS)などでは、患者の約90%に22q11.2欠失があると報告されていますが、染色体欠失を伴わない患者も存在します (図3) 。
- CRKLおよびCRK遺伝子
CRKは最初、トリ腫瘍ウイルスCT10に取り込まれたがん遺伝子としてBruce Meyer博士をはじめとする故・花房秀三郎博士らのグループによって発見されました。のちに、正常なCRKとそれに類似した遺伝子CRKL(CRK-Like)がヒトゲノム中に存在することが見つかっています(CRKは染色体上の17p13;CRKLは22q11.2に存在)。両遺伝子は進化途中のゲノム重複によりできたと推測され、脊椎動物ゲノムに広く存在することがImamotoらとの共同研究により確認されています。シカゴ大のImamotoらは、マウスをモデルとした実験を行い、CRKLが22q11.2欠失症候群の候補遺伝子であり、CRKLの欠失が胎生期に心血管形成を含む神経堤細胞由来の臓器の異常を引き起こすことを世界ではじめて報告しています。また、22q11.2欠失症候群の症状のうちの、少なくとも、腎泌尿器疾患にはTBX1ではなくCRKLが関与する可能性が高いことがImamotoらを含む多数の研究室の共同研究により報告されています。
- オミクス解析
オミクス解析は、数千から数十万の生体内分子を一度に網羅的に測定し、解析する手法です。2003年に解読されたヒトゲノムの情報を基盤として、全遺伝子の発現プロファイリング(トランスクリプトーム)、DNAなどの修飾(エピゲノム)、代謝物(メタボローム)、蛋白質(プロテオーム)などを測定する技術がこの10数年間で急速に進展しました。これらの手法を用いることにより、全く新しい発見ができるようになりました。特に、本研究では、網羅的遺伝子発現およびエピゲノム解析(東京大学大学院新領域創成科学研究科)、代謝物解析(慶應義塾大学先端生命科学研究所)の疾患解明における有効性が改めて明らかになりました。
- データ駆動型研究
オミクス解析などから得られる大量のデータを出発点として進める研究をデータ駆動型研究と呼びます。これに対して、何らかの仮説を元にして進める研究を仮説駆動型研究と呼びます。データ駆動型研究は、情報科学や人工知能(AI)の発達、および数学などとの組み合わせにより、今後、生物学や医科学の主流のひとつになると考えられます。
- 中心糖代謝系
中心糖代謝系とは、解糖系といった、主に炭水化物などの食物の分解などにより得たグルコース(糖)を生化学反応により変換し、アセチル-CoAの生成を経て、細胞内の主要なエネルギー通貨であるATPを生成する最初の経路です。解糖系は、また、多くの生合成経路への橋渡しも行っています。中心糖代謝系の異常が関わる代表的な疾患としては、糖尿病などが挙げられますが、近年はがんをはじめとした疾患にも糖代謝の変化が起こることが報告されています。
