茶カテキンが遺伝子発現に関わるタンパク質機能を制御する新たな仕組みを解明
発表のポイント
・生体内の遺伝子発現を制御する「メチル化」をコントロールする薬剤を化合物ライブラリから探索する仕組みを確立し、1,000種類を超える化合物から目的の活性を有する化合物を見出した。
・緑茶などに含まれるカテキン類 が、酵素カテコールメチルトランスフェラーゼ の活性を介して大腸がん細胞の「メチル化」状態を低下させることを明らかにした。
・緑茶の摂取の健康に与える効果の一端を説明する端緒となる成果が得られた。
概要
東京大学大学院薬学系研究科の荻原洲介大学院生、小松徹特任助教、浦野泰照教授、京都府立医科大学大学院医学研究科の伊藤幸裕准教授、大阪大学産業科学研究所の鈴木孝禎教授、東京大学創薬機構の小島宏建特任教授、岡部隆義特任教授、長野哲雄客員教授らは、緑茶に含まれるカテキンが遺伝子発現に関わるタンパク質の機能を制御する新たな仕組みを解明しました。本研究成果は、12月23日付で Journal of the American Chemical Society 誌に掲載されました。
細胞の機能の維持において、必要な遺伝子が必要な場所やタイミングで正しく発現されることが重要であり、この過程はさまざまな因子によって厳密に制御されていることが知られています。そして、このような遺伝子発現を決定するエピジェネティック制御因子 の代表的なものに、タンパク質、DNAに「メチル基」という化学構造を修飾する酵素反応があります。近年、このようなメチル基の修飾をおこなう酵素の細胞内の活性が、メチル基の供給源となる補酵素S‐アデノシルメチオニン(SAM) の細胞内濃度によって制御されることが明らかになっており、細胞内のSAM濃度異常と、さまざまな疾患の関わりの理解に注目が集まっています。
研究チームは、選択的な酵素反応を利用してSAMを蛍光検出することを可能とする有機小分子蛍光プローブを開発し、細胞内のSAM濃度を変化させる薬剤を効率的に探索する実験系を確立しました。そして、SAM濃度の上昇が病態の悪化に寄与することが示唆されている大腸がんを対象とし、既存の薬剤や生理活性化合物からなる1,600化合物のライブラリの中から、大腸がん細胞のSAM濃度を低下させる薬剤の探索をおこないました。
その結果、緑茶などに含まれる天然物であるカテキン類が、大腸がん細胞のSAM濃度を大きく低下させることを発見しました。このメカニズムについて詳細に調べたところ、カテキンが、大腸がん細胞が発現する薬物代謝酵素の一種であるカテコールメチルトランスフェラーゼ(COMT)によってメチル化される際にSAMを消費することによって、細胞内のSAM濃度の減少を引き起こすことが明らかとなりました。そして、カテキンによるSAM濃度の低下によって、大腸がん細胞におけるヒストンタンパク質 のメチル化の低下が起こり、細胞死を起こしやすくなることが確かめられ、カテキンが、COMTの活性を介してSAM濃度を低下させ、大腸がん細胞の悪性化に関わる表現型を制御するという新たな作用の発見に至りました。
現在までに、緑茶や、その主成分であるカテキン類の健康への効果について多くの研究がなされています。カテキンの細胞レベルでの作用として、抗酸化作用、酵素の阻害、タンパク質の化学修飾などさまざまなものが知られている一方で、これらの作用からだけでは、その健康への効果は十分に説明されていません。今回新たに見出されたカテキンによるSAM濃度の低下作用と、これによるタンパク質のメチル化状態の制御作用は、緑茶、カテキンの健康への効果を説明する鍵となる新たな知見を与えるものであると期待されます。
発表内容
ヒトの細胞には、約20,000種類の遺伝子が存在していることが知られていますが、これらの発現の組み合わせによって、多様な細胞の機能が維持されています。これらの遺伝子の発現は、エピジェネティック制御因子と総称されるさまざまなメカニズムによって制御されており、この仕組みを理解することは、生命の成り立ちや疾患のメカニズムを知る上でも重要な意味をもちます。そして、このような制御因子のうちで代表的なもののひとつが、ヒストンなどのタンパク質やDNAに「メチル基」という化学構造を修飾する仕組みです。ヒストンタンパク質のメチル化や、DNAの特定部位のメチル化は、関連する遺伝子の発現レベルを抑制する方向にはたらき、このような細胞内のメチル化状態の異常は遺伝子の発現レベルの異常にも繋がることから、疾患と関わる細胞内のメチル化状態の変化の理解を目指す研究や、これを担うメチル基転移酵素のはたらきを制御する薬剤の開発が精力的に進められています。
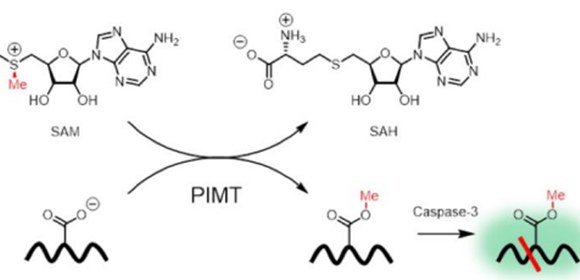
一方、近年の研究から、細胞内のメチル基転移酵素の活性は、これらの酵素がメチル基の供給源として用いる補酵素S‐アデノシルメチオニン(SAM)濃度の変化によって制御されることが明らかになっています (図1) 。SAM濃度の変化ががんや生活習慣病などの疾患の成り立ちと関わる例も報告されており、疾患と関わるSAM濃度の変化の仕組みを理解し、これを制御する方法論の開発が求められていました。
このような背景を受けて、小松特任助教らの研究チームは、細胞内のSAM濃度の変化を、これと選択的に反応して蛍光性となる有機小分子蛍光プローブを用いて検出する実験系の開発をおこないました。これは、以前に同チームが開発した、SAMを消費して特定の基質にメチル基を転移する酵素活性を選択的に可視化する蛍光プローブを応用したもので、その構造を最適化して、高いシグナル/ノイズ比をもってこの酵素反応を検出することができるようにしたことで、10nM以下という非常に微少な濃度のSAMを、30分以内に検出することが可能となりました (図2) 。これは、細胞内に含まれるSAMを蛍光検出するのに十分な感度であり、細胞内のSAM濃度変化を高い定量性を持って評価することが可能であることが確かめられました。
そして、この実験系を利用して、大腸がん細胞のSAM濃度を低下させる薬剤の探索研究を実施しました。大腸がんにおいては、その初期段階からSAMの濃度上昇が見られ、これが、ヒストンなどのメチル化状態の変化を介してがんの悪性化に寄与していることが示唆されています。東京大学創薬機構が保有する既存の薬剤や生理活性化合物からなる1,600化合物のライブラリを用いたスクリーニングをおこなったところ、大腸がん細胞のSAM濃度を低下させる薬剤を複数発見することに成功しました (図3) 。
そして、これらの化合物の中に、緑茶などに含まれる天然物であるカテキンやその類似化合物が多く含まれていることに着目し、そのメカニズムについて精査をおこなったところ、大腸がん細胞が発現する薬物代謝酵素の一種であるカテコールメチルトランスフェラーゼ(COMT)が、これらのカテキン類をメチル化する際にSAMを消費することによって、細胞のSAM濃度の減少が引き起こされることが明らかとなりました。そして、この作用は、培養細胞系だけでなく、大腸がんのモデルマウスにカテキンを含む餌を食べさせて飼育した場合にも観察されることが明らかとなりました (図4) 。
そして、カテキンによるSAM濃度の低下が、実際に大腸がん細胞の表現系に影響を与えるかについて検証をおこないました。大阪大学の鈴木教授、京都府立医科大学の伊藤准教授らと共同し、大腸がんにおけるヒストンタンパク質のメチル化状態の変化を調べたところ、カテキンの作用によって、大腸がん細胞のヒストンのメチル化レベルが大幅に低下し、内在性のアポトーシス誘導因子によって引き起こされる細胞死への感受性が大きく高まることが確かめられました (図5) 。以上の結果は、カテキンが、COMTの活性を介してSAM濃度を低下させ、大腸がん細胞の表現型を制御するという新たな作用の存在を示した結果となります。
現在までに、緑茶や、その主成分であるカテキン類の健康への効果について多くの研究がなされています。カテキンの細胞レベルでの作用として、抗酸化作用、酵素の阻害、タンパク質の化学修飾などさまざまなものが知られている一方で、これらの作用からだけでは、その健康への効果は十分に説明されていません。今回新たに見出されたカテキンによるSAM濃度の低下作用と、これによるタンパク質のメチル化状態の制御作用は、緑茶、カテキンの健康への効果を説明する鍵となる新たな知見を与えるものであると期待されます。
なお、本研究成果は、国立研究開発法人科学技術振興機構(さきがけ「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」)、日本学術振興会(科研費15H05371、15K14937、17K19477、18H04538、19H02846)、創薬等支援技術基盤プラットフォーム、持田記念医学薬学振興財団、内藤記念科学振興財団、東京生化学研究会をはじめとする諸機関からの研究支援によって得られた成果です。
発表雑誌
雑誌: Journal of the American Chemical Society
題名:“Metabolic Pathway-oriented Screening Targeting S-Adenosyl-L-methionine Reveals the Epigenetic Remodeling Activities of Naturally Occurring Catechols”
著者:Shusuke Ogihara, Toru Komatsu*, Yukihiro Itoh, Yuka Miyake, Takayoshi Suzuki, Kouichi Yanagi, Yusuke Kimura, Tasuku Ueno, Kenjiro Hanaoka, Hirotatsu Kojima, Takayoshi Okabe, Tetsuo Nagano, and Yasuteru Urano *
DOI番号:doi:10.1021/jacs.9b08698
アブストラクトURL: http://dx.doi.org/10.1021/jacs.9b08698
参考図
図1 (左)S‐アデノシルメチオニン(SAM;左下の分子構造)によるメチル化の様子。SAMのメチル基が、メチル基転移酵素のはたらきによってDNA、タンパク質などに転移される。(右)SAMの細胞内濃度とDNA、タンパク質のメチル化の関係性の概念図。細胞内のSAM濃度が高すぎる、低すぎることによって、DNA、タンパク質のメチル化状態が変化し、遺伝子発現の変化などが引き起こされる。
図2 開発した蛍光プローブによるSAMの検出の概念図と、異なるSAM濃度(0-100nM)での蛍光上昇の様子。濃度に応じて蛍光強度が増大する様子から、SAM濃度を定量することが可能。
図3 大腸がん細胞のSAM濃度を低下させるヒット化合物の構造(左)。左上がカテキンの構造式。カテコールメチルトランスフェラーゼ(COMT)の活性との関わりを支持する結果として、COMTの活性を抑える既存の薬剤を加えた際には、大腸がん細胞のSAM濃度が上昇する様子が観察された(右)。
図4 (左)カテキンによるSAM濃度低下の作用機序.COMTがSAMを用いてカテキンをメチル化することでSAMが消費される。(中央)細胞レベルでのSAM濃度の低下の様子。(右)大腸がんモデルマウスにおいてカテキン(食餌中1%)を摂取させた際のがん組織のSAM濃度。カテキンが含まれる餌(赤)において、有意にSAM濃度の減少が見られる。
図5 (左)カテキンの添加によるヒストンのメチル化状態の変化。カテキンを加えることによって(左から2番目のレーン)ヒストンのメチル化が低下する様子が観察された。(右)内因性のアポトーシス誘導因子TRAILによる細胞死の誘導をカテキンが増強する様子が観察された(グラフ縦軸はTRAIL処理後に生存している細胞数)。この作用は、既存のヒストンメチル基転移酵素の阻害剤の制がん作用のメカニズムのひとつと考えられているものである。
参考URL
大阪大学 産業科学研究所 鈴木研究室HP
https://www.sanken.osaka-u.ac.jp/labs/cmc/
用語説明
- カテキン類
茶葉などに含まれるフラボノイドの誘導体である一連のポリフェノール類。芳香族に水酸基が2つ結合したカテコール構造を有し、強い抗酸化作用を有することが知られている。
- エピジェネティック制御因子
エピジェネティクスとは、「DNAの配列変化によらない遺伝子発現を制御・伝達するシステムおよびその学術分野」(出典:脳科学辞典)と定義されるが、生体内でこれを制御する様々な因子の存在が知られており、これらのメカニズムの理解に向けて精力的な研究が進められている。代表的なものに、DNAのメチル化修飾、ヒストンタンパク質のアシル化、メチル化修飾などが知られており、これらは、クロマチン(DNA、タンパク質複合体)の構造を変化させ、特定の遺伝子の発現をコントロールする役割を有する。
- S‐アデノシルメチオニン(SAM)
生体内の多くのメチル基転移酵素が補酵素として用いる代謝物。反応性の高いメチル基を有し、これが、対応するメチル基転移酵素の活性によってDNA、タンパク質、小分子代謝物などに転移される。
- カテコールメチルトランスフェラーゼ(COMT)
S‐アデノシルメチオニンを用いてカテコール分子にメチル基を転移する酵素。ドーパミンなどの生理活性分子の代謝や、カテコール構造を有する薬剤の代謝に関わることが知られている。
- ヒストンタンパク質
クロマチンを構成する主要なタンパク質。強い塩基性を有するタンパク質であり、酸性のDNAとの高い親和性を示す。ヒストンのテール部分の構造が様々な酵素のはたらきによって翻訳後修飾を受けることが知られており、これによってDNAとの親和性が変化することが、クロマチンの構造変化、遺伝子発現の変化に繋がる。
