小児肝がんの新規発症機序を解明
肝芽腫の新たな分子標的の同定と治療法の開発
研究成果のポイント
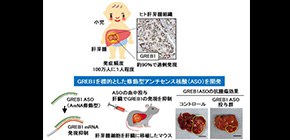
・小児肝がんである肝芽腫 の原因となる遺伝子GREB1 を同定し、GREB1を標的とした医薬品となるアンチセンス核酸 を開発
・100万人に1人の稀ながんで、原因が不明だった肝芽腫の発症メカニズムを解明
・肝芽腫を治療できるGREB1を標的とした分子標的治療薬の開発に期待
概要
大阪大学大学院医学系研究科の松本真司助教と菊池章教授(分子病態生化学)らの研究グループは、小児の肝臓に発生する稀な悪性腫瘍である肝芽腫の原因となる遺伝子GREB1の同定に成功しました。肝芽腫は世界的には100万人に1名程度の発症頻度で、希少疾患であることから、これまでその発症メカニズムについては解明されておらず、効果の高い分子標的治療薬の開発も遅れていました。
今回、菊池教授らの研究グループは、肝芽腫において異常活性化するWnt(ウィント)シグナル によって発現が誘導される遺伝子としてGREB1を同定し、肝芽腫組織の約90%でGREB1タンパク質が過剰に発現して、肝芽腫の形成を促進することを見出しました。さらに、GREB1の発現を抑制する、血中安定性と腫瘍集積性が高い修飾型アンチセンス核酸(ASO)を、肝芽腫細胞を移植したマウスに投与したところ、がん細胞の増殖と腫瘍形成を抑制する効果があることが分かりました。したがって、今回の発見が今後、原因が未解明であった肝芽腫に対して新たな分子標的治療薬の開発に貢献することが期待されます。
本研究成果は、英国科学誌「Nature Communications」(オンライン)に、8月28日(水)午後6時(日本時間)に公開されました。
図1
研究の背景
肝芽腫は小児の肝臓に発症する悪性腫瘍で、日本国内では年間30~40名、世界的には、100万人に1名程度の頻度で発生する稀な疾患で、発生原因も明らかにされていませんでした。腫瘍が大きくなるまでは無症状であることが多く、発見された時点では、腫瘍が大きすぎて手術ができなかったり、すでに肺などに転移している時は生存率が低下します。しかし、手術以外の化学療法では、重篤な副作用が問題となっています。そのため、肝芽腫に対する副作用が少なく、良好な治療効果の得られる新規の分子標的治療薬の開発が待望されていました。
本研究の成果
今回、菊池教授と松本助教は、同研究科の小児外科、消化器内科、病理学の研究グループとの共同研究で、肝芽腫における新たな分子標的としてGREB1を同定しました。菊池教授らのグループは、肝芽腫において高頻度に異常活性化することが知られているWntシグナルによって誘導される下流遺伝子を網羅的に探索してGREB1を同定し、肝芽腫の約90%の患者においてGREB1が過剰に発現することを見出しました。GREB1を発現する肝芽腫細胞でGREB1の発現を抑えると、細胞の増殖が阻害され、細胞死が誘導されました。また、GREB1は肝芽腫細胞の核内でTGFβシグナルの主要構成因子であるSmad2/3 という細胞増殖の制御因子と結合して、その働きを抑えることにより、肝芽腫の増殖を促進する分子メカニズムを解明しました。
さらに、肝芽腫の治療開発を目的として、細胞内タンパク質であるGREB1の発現を抑制するための修飾型アンチセンス核酸を大阪大学大学院薬学研究科生物有機化学分野との共同研究で新たに開発しました。肝芽腫細胞を移植したマウスに開発したアンチセンス核酸を投与したところ、GREB1の発現と腫瘍形成を抑制する効果があることが分かりました。
本研究成果が社会に与える影響(本研究成果の意義)
肝芽腫は小児に特異的な疾患で、発生頻度の低い稀な希少がんであることから、発症のメカニズムの解明や分子標的治療薬の開発が十分に進んでいませんでした。本研究成果により、遺伝子変異による高頻度なWntシグナルの異常活性化がGREB1の発現を介して、肝芽腫の形成を促進する分子メカニズムが初めて解明されました。また、本研究で開発したGREB1に対する修飾型アンチセンス核酸が肝芽腫の形成を阻害する効果を有していたことから、今回の発見は、肝芽腫の新たな分子標的治療薬の開発に貢献することが期待されます。
研究者のコメント(菊池章教授)
肝芽腫のような希少疾患は、対象患者数が少ないことから製薬企業が創薬対象としない傾向がありました。しかし、世界規模で考えれば相当数の患者がおられますので、製薬企業がクローバル展開するための重要な視点となります。また、このような希少疾患の新薬開発に対しては、公的資金を投入して企業導出へ繋ぐ政策も求められます。
特記事項
本研究成果は、2019年8月28日(水)午後6時(日本時間)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
【タイトル】 “GREB1 induced by Wnt signaling promotes development of hepatoblastoma bysuppressing TGFβ signaling”
【著者名】 Shinji Matsumoto 1 , Taku Yamamichi 1,2 , Koei Shinazawa 1 , Yuuya Kasahara 3,4 , Satoshi Nojima 5 , Takahiro Kodama 6 , Satoshi Obika 3,4 , Tetsuo Takehara 6 , Eiichi Morii 5 , Hiroomi Okuyama 2 , and Akira Kikuchi 1
【所属】
1. 大阪大学 大学院医学系研究科 分子病態生化学
2. 大阪大学 大学院医学系研究科 小児成育外科学
3. 大阪大学 大学院薬学研究科 生物有機化学分野
4. 国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター
5. 大阪大学 大学院医学系研究科 病態病理学
6. 大阪大学 大学院医学系研究科 消化器内科学
なお、本研究は、日本学術振興会 科学研究費助成事業、公益財団法人 金原一郎記念医学医療振興財団 研究費助成事業、公益財団法人安田記念医学財団 研究費助成事業の一環として行われました。
大阪大学 大学院医学系研究科 小児外科 奥山宏臣教授、消化器内科 竹原徹郎教授、病理学 森井英一教授、同薬学研究科 生物有機化学分野 小比賀 聡教授の協力を得て行われました。
参考URL
大阪大学 大学院医学系研究科 分子病態生化学
http://www.med.osaka-u.ac.jp/pub/molbiobc/index.html
用語説明
- 肝芽腫
子どもの肝臓に発生する悪性腫瘍(がん)のうち、最も頻度の高いものが「肝芽腫」と呼ばれる病気で、小児固形がんとしては,神経芽腫・ウイルムス腫瘍(腎芽腫)に次いで多いとされている。ほとんどは3歳以下の幼児に発生するが、時に年長児でも発生する。治療は手術と抗がん剤(化学療法)の組み合わせが基本となる。発見された時点で、腫瘍が大きすぎて手術ができなかったり、すでに肺などに転移している時は、化学療法による治療が必須となる。
- GREB1
(growth regulation by estrogen in breast cancer 1):
細胞内に存在するタンパク質。もともとは、乳がん細胞のホルモン依存的な増殖に関与することが知られていたが、肝芽腫との関連は不明であった。
- アンチセンス核酸
標的と相補的な配列を有する一本鎖の核酸(DNA)である。特に、標的遺伝子のmRNAに相補的な配列を持ったアンチセンス核酸は、その遺伝子の発現を抑制することが出来ることから医薬品(核酸医薬)への応用が期待されている。しかし、核酸医薬は血中の安定性や臓器への集積性等の問題から、これまでに医薬品として実用化された例は少なく、特に抗がん剤としては実用化されていない。本研究で用いるアンチセンス核酸は、大阪大学にて開発が進められてきた化学修飾を付加したAmNA(アムナ)架橋型人工アンチセンス核酸と呼ばれるもので、血中安定性と腫瘍集積性が高いことから、新規の抗がん剤として実用化されることが期待されている。
- Wnt(ウィント)シグナル
Wntは、細胞の外に分泌されるタンパク質で、Wntが細胞に作用することにより、活性化される細胞内シグナル経路をWntシグナルと呼ぶ。Wntが受容体に結合すると、細胞の分化、増殖および遊走などが調節される。Wntシグナル経路を構成するいくつかの因子における遺伝子変異は、発がんを引き起こすことが知られている。肝芽腫では、約8割の症例でWntシグナルが異常活性化していて、特に構成因子であるβカテニンの遺伝子変異が7割の高頻度で認められるが、Wntシグナルがどのように肝芽腫の発症を誘導するかは不明であった。
- Smad2/3
細胞外分泌タンパク質であるトランスフォーミング増殖因子β(TGFβ)によって活性化されるシグナル経路の主要な構成因子として、核内で遺伝子の発現を調節する。TGFβは、多くの細胞の増殖を抑制する作用を有していることが知られており、Smad2/3を含むTGFβシグナルに関連するタンパク質の遺伝子変異(機能の喪失)ががん化に関与していると言われている。しかし、これまでにSmad2/3が肝芽腫の発症にどのように関与するのかについては明らかになっていなかった。
