生命の起源-地球上にポリペプチドが出現したルートの解明にもつながる成果
位置選択的ペプチド結合合成法の発見
研究成果のポイント
・人工的なタンパク質合成では、アミノ酸同士の適切なペプチド結合を誘導するため、結合させたい部分以外が反応に使われないよう保護基を用いて化学的にマスクする必要があった。
・本研究では、アミノ酸のカルボキシ基上の一つの酸素原子を硫黄原子に換えたα-アミノチオアシッドを、酸性の溶液中で鉄鉱石などの酸化鉄と混ぜると天然型のポリペプチド が数分で作られることを見つけた。
・この反応では、アミノ酸でも、特異な反応機構により生体内の合成と同様にポリペプチドを合成できる。
・地球上にアミノ酸が出現した際、α-アミノチオアシッドも火山ガスの影響で作られた可能性が示唆されており、本研究で見出された反応は、天然型のポリペプチドの効率的な合成法だけでなく、地球上にポリペプチドが出現したルートの解明にもつながる成果であり、生命の起源をめぐる議論を進展させる可能性がある
概要
大阪大学大学院理学研究科化学専攻有機生物化学講座の岡本亮講師、大学院生の原口拓也(博士前期課程)、野村幸汰(博士前期課程)、真木勇太助教、梶原康宏教授および高知大学教育研究部総合科学系複合領域科学部門の和泉雅之教授(研究当時:大阪大学大学院理学研究科化学専攻 准教授)らのグループは、硫黄原子を含むアミノ酸の一種、α-アミノチオアシッドの酸化反応が位置選択的 にアミノ酸間のペプチド結合を生じさせることを発見しました。
この実験では、天然に存在する20種類のアミノ酸のうちの幾つかを、それぞれα-アミノチオアシッドへ変換後、酸化された鉄試薬と混ぜると、天然型のポリペプチドが作られることを発見しました (図1) 。ポリペプチドは、さらにコンパクトに折りたたむと生命活動を維持するために必要なタンパク質となります。今回の発見から、地球に生物が誕生する前の環境に近い条件でも、ポリペプチドが作られる可能性が示唆されたため、実際に単純な酸性水溶液中で鉄鉱石の塊とα-アミノチオアシッドを混ぜたところ、自発的にペプチドが作られることを確認しました。このことから本研究は、天然型のポリペプチドの新しい合成法を提案するだけでなく、地球上にポリペプチドが出現した新たなルートの存在を示唆する結果となりました。
本研究成果は、2019年2月21日(木)(日本時間)米化学会誌“Biochemistry”に発表されました。また、この成果のイメージが雑誌(58巻12号誌)のカバー画像としても採用されています。( https://pubs.acs.org/toc/bichaw/58/12 )
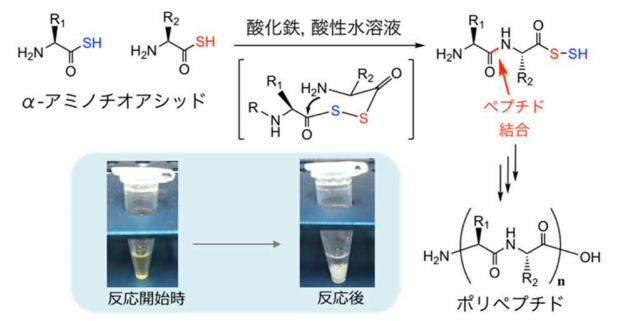
図1 α-アミノチオアシッドを利用したペプチド合成
α-アミノチオアシッド(a)は、α-アミノ酸(b)のカルボキシ基の酸素原子がひとつ硫黄原子に置き換えられたものである。塩化鉄を含む酸性溶液に、フェニルアラニンのα-アミノチオアシッド(c)を溶かして静置するとフェニルアラニンポリペプチド(e)がつくられ沈殿物(g)となる。
研究の背景
ポリペプチドやタンパク質は、アミノ酸のα位にあるアミノ基と別のアミノ酸のカルボキシ基がペプチド結合で連続的につながった分子です。ポリペプチドは、10個(程度)以上のアミノ酸がつながった分子で、直鎖構造や環状構造をもちます。一方、タンパク質はポリペプチドの鎖がさらに折りたたまれることで、らせん構造(ヘリックス)や板上構造(ストランド)などの特別な立体構造をもつ分子です。
生体内では、DNA、RNA、リボソーム、酵素が連携して遺伝子の暗号通りにタンパク質をつくります。また、バクテリアなどから単離されたアミノ酸が10−20個程度つながったポリペプチドは、薬として期待されるものが多く、その合成法の開発が広く検討されてきました。
人工的なポリペプチドの化学合成では、結合させるαアミノ基とカルボン酸以外の官能基を保護基という化学的マスクでふさいでおくことで、アミノ酸同士をペプチド結合によってつなぎ、ポリペプチドといわれるアミノ酸の鎖を直線的に伸ばしていきます。この際、保護基がない状態では、アミノ酸同士が側鎖のアミノ基とペプチド結合をつくります。その結果、ポリペプチドが枝状にわかれて伸びるため天然に存在する直線型ポリペプチドは得られません。しかし、保護基を利用するために、合成に必要な工程数が増えるという問題点がありました。
研究の内容
今回、同グループは、酸化された鉄試薬である塩化鉄(FeCl3)を用いて、α-アミノチオアシッドを酸性水溶液中で酸化させることにより、アミノ酸がペプチド結合を自発的に形成し、アミノ酸のポリマーすなわちポリペプチドが迅速に得られることを発見しました。得られたポリペプチドを分析すると、α位にあるアミノ基と別のアミノ酸のカルボキシ基がペプチド結合を形成していることがわかりました。その結果、本反応には位置選択的ペプチド結合を形成するメカニズムがあると考えられました。様々な検証実験の結果から、その反応中間体には、ジアミノアシルジスルフィド体が作られ、選択的なペプチド結合を与えたと考えられます。これにより、無保護アミノ酸を、有機化学的な試薬なしで連続的に、かつ水のなかでポリペプチドをつくる方法を見つけることができました。
このα-アミノチオアシッドは原始的な地球環境でも十分に存在すると考えられています。同研究グループは生物が出現する前の前生物的環境においてペプチドがα-アミノチオアシッドの酸化により生じうると考えました。そこで、原始環境を模した系として、鉄鉱石(Fe2O3)共存下でα-アミノチオアシッドを酸性溶液中に溶かし静置したところ、リジン、フェニルアラニンからなるポリペプチドが生じることを確認しました (図2) 。これは、α-アミノチオアシッドを鍵とする、RNAに依存しない新たなポリペプチドの前生物的合成ルートの可能性を示唆する結果となりました。本研究結果は、α-アミノチオアシッドの酸化反応が化学選択的なペプチド結合を生じることを見出しただけでなく、この反応が、地球上にポリペプチドが出現した過程に利用された可能性を示唆しています。本有機生物化学講座では、二代目の教授である赤堀四郎先生(1939-1960に教授、1960-1966に大阪大学7代総長)のときに、地球上にポリペプチドが出現した化学的メカニズムを探る研究を開始していましたが、今回の発見は、その一つの答えとなりました。
図2 鉄鋼石の表面に溜まった酸性溶液からペプチドが生成
本研究成果が社会に与える影響
保護基が不要であるチオアシッドを鍵とした新たなペプチド合成法は、今後のペプチド合成化学における基盤となります。また、前生物環境におけるポリペプチドの新たな合成ルートと思われるものが見つかったことは、生命の起源についての議論を大きく前に進めると期待されます。
特記事項
本研究成果は、2019年2月21日(木)(日本時間)に米化学会誌“Biochemistry”に掲載されました。
タイトル: “Regioselective α-peptide bond formation through the oxidation of amino thioacids”
著者名: Ryo Okamoto, Takuya Haraguchi, Kota Nomura, Yuta Maki, Masayuki Izumi, and Yasuhiro Kajihara
DOI: 10.1021/acs.biochem.8b01239
なお、本研究は、科学研究費補助金による支援のもとに行われました。
参考URL
大阪大学 大学院理学研究科 化学専攻 有機生物化学研究室 梶原研究室
http://www.chem.sci.osaka-u.ac.jp/lab/kajihara/
用語説明
- ポリペプチド
10個(程度)以上のアミノ酸が、化学結合(ペプチド結合)によりつながった分子をポリペプチドという。ポリペプチドはさらにコンパクトな形へ折りたたまれることでタンパク質となり、酵素やホルモンとして体内の様々な生命活動を維持している。
- 位置選択的
一般的に一つの分子の中には、他の分子と化学反応を起こすことができる部位を複数持っている。このうち、ある特定の部位(=位置)で化学反応をおこすことを位置選択的という。ポリペプチドを合成するには、アミノ酸が持つ特定のアミノ基とカルボキシ基という部位(=位置)の間で、選択的にペプチド結合を作りアミノ酸を連結しなければならない。
