光合成電子リレーで電子を再利用する仕組みを解明
光合成電子伝達鎖の新メンバーの構造を可視化
研究成果のポイント
・光合成電子伝達を担う膜タンパク質複合体のうち,唯一構造が判っていなかったNDH様複合体(NDH1)の構造決定に成功
・光合成電子伝達鎖を構成する巨大な膜蛋白質が,末端の電子伝達蛋白質(フェレドキシン)から電子を回収し再利用する仕組みを解明
・今後,光合成の人工的な最適化や光合成機能の強化につながる可能性
概要
大阪大学蛋白質研究所の栗栖源嗣教授らの研究グループは,ドイツ・ルール大学のマーク・ノヴァスツック助教,横浜市立大学の池上貴久教授らと共同で,光合成で働く巨大な膜蛋白質(NDH様複合体 )が,光合成電子伝達鎖の電子伝達蛋白質(フェレドキシン)から電子を回収し,チラコイド膜中で再利用する仕組みの解析に成功しました。
植物や藻類が行う光合成反応は,地球上の全ての生命体を支える重要な反応で,光エネルギーを使って発電する太陽電池のような反応です。発電に相当する反応は“電子伝達”と呼ばれ,チラコイド膜 中の複数の膜蛋白質で構成される回路と可溶性の電子伝達蛋白質が行っています。水から得られた電子はチラコイド膜の回路を伝って光化学系Iと呼ばれる巨大な膜蛋白質に伝わり,最後の受け手である電子伝達蛋白質(フェレドキシン:Fd)に電子をバトンパスすることで,様々な酵素に電力が供給されています。しかし,光環境によっては過剰な電子が生産されることがあるため,チラコイド膜の回路に電子を回収し再利用するNDH様複合体(NDH1)の存在が知られていました。しかし,NDH1が電子を回収・再利用する詳細な仕組みは解明されていませんでした。
今回,栗栖教授らの国際共同研究チームはチラコイド膜に電子を回収するNDH1の構造解析に成功しました。昨年度のノーベル化学賞受賞で注目されたクライオ電子顕微鏡による単粒子構造解析 を行い,巨大で不安定な膜蛋白質複合体の構造を決定しました。さらに,NDH1の構成成分のうちフェレドキシンが結合する部分のX線構造解析 とNMRを用いた相互作用解析から,フェレドキシンを引き寄せて結合し,電子をチラコイド膜に循環させて電子回路を調整する仕組みを突き止めました (図1) 。
今後,フェレドキシンからの電子伝達経路を詳細に解析することで葉緑体の電子回路の改変指針を得る事が出来れば,光合成の人工的な最適化や光合成機能の強化につながる可能性があります。
本研究成果は,米国科学誌「Science」に,12月21日(金)午前4時(日本時間)に公開されました。
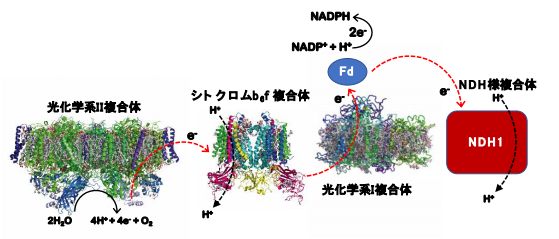
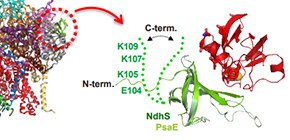
図1 光合成電子伝達を構成する膜蛋白質の回路を表した図
Fd(フェレドキシン)の結合によりチラコイド膜に電子を回収・循環させる仕組み。NDH様複合体(NDH1)だけ立体構造が判っていなかった。
研究の背景
光合成反応は,地球上の全ての生命体を支える重要な反応で,生成する酸素や取り込む二酸化炭素の量が地球環境を決定づけているといっても過言ではありません。光合成反応は光エネルギーを化学エネルギーに変える電子伝達部と,その化学エネルギーを利用して二酸化炭素を取り込む部分とに分かれています。光合成電子伝達と呼ばれる電子伝達部は主に3種の巨大蛋白質複合体(光化学系Ⅰ及びⅡ,チトクロムb 6 f複合体)により構成されていますが (図1) ,今回注目した“NHD様複合体”は第4の複合体として,その役割に注目が集まっていました。光化学系I及びⅡ,チトクロムb 6 f複合体の構造はすでに報告されていましたが,電子回路を調節するNDH様複合体(NDH1)は,蛋白質量が少ないうえに不安定な膜蛋白質複合体であるため単離・精製が難しく,その全体構造と電子を回収する分子メカニズムは不明でした。
研究の内容と成果
栗栖教授らの国際共同研究グループでは,NDH様複合体(NDH1)の精製方法を改良することで,均質な膜蛋白質複合体を得ることに成功し,クライオ電子顕微鏡画像を複数撮影して複合体蛋白質の構造を原子分解能で解析,NDH1の構造決定に成功しました (図2:左) 。また,フェレドキシンが結合するNdhSと呼ばれる領域だけを組換え体として調製し,電子伝達蛋白質が,このNdhS領域とどのように結合するのかをX線とNMRを用いて解析しました (図2:右) 。NDH様複合体はNdhSのC末端にあるフラフラした領域を使い,フライフィッシングの要領でフェレドキシンを捕まえて電子を回収していることを突き止めました。以上のことから,世界で初めて電子伝達蛋白質フェレドキシンがNDH1の電子供給元であることを実証しました。
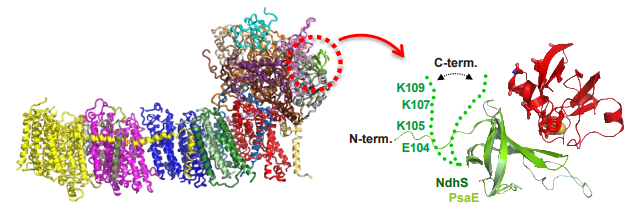
図2 NDH様複合体の構造とフェレドキシンとの複合体形成様式
(左)膜の横から見たNDH様複合体(NDH1)の立体構造。Fdと結合する領域を緑色のリボンモデルで表し赤い破線で表示して囲っている。
(右)左図の赤い波線に対応するNdhSサブユニットを切り出して,高分解能のX線構造とNMRを用いて確認したフェレドキシン(赤色)との複合体構造図。
本研究成果が社会に与える影響(本研究成果の意義)
電子伝達は相互作用が弱いにもかかわらず非常に特異的に進行する反応で,特に光合成生物では様々な調節機構を持っています。本研究成果のように,巧妙な活性化機構を理解することで植物や藻類の改変指針を得ることが出来れば,光合成の人工的な最適化や光合成機能の強化につながる可能性があります。
研究者のコメント(大阪大学 蛋白質研究所 栗栖教授)
農学系学部を持たない阪大で,植物や藻類の光合成研究を展開するため,大学の支援を受けてドイツの大学(ルール大学ボーフム)と共同研究を進めてきました。構造生物学を得意とする阪大とは,win-winの関係で良好な共同研究を進めることが出来ました。
特記事項
本研究成果は,2018年12月21日(金)午前4時(日本時間)に米国科学誌「Science」にオンライン先行掲載されました。
タイ トル : “Structural adaptations of photosynthetic complex I enable ferredoxin-dependent electrontransfer”
著者名:Jan M. Schuller * , James A. Birrell, Hideaki Tanaka 1 , Tsuyoshi Konuma 2 , Hannes Wulfhorst, NicholasCox, Sandra K. Schuller, Jacqueline Thiemann, Wolfgang Lubitz, Pierre Sétif, Takahisa Ikegami 2 ,Benjamine D. Engel, Genji Kurisu *,1 and Marc M. Nowaczyk *
*記が責任著者。1で表記した2名が大阪大学,2で表記した2名が横浜市立大学で行った研究成果。
なお,本研究は,科学技術振興機構(JST)戦略的創造研究推進事業CREST研究の一環として横浜市立大学との共同研究,さらに大阪大学から国際共同研究促進プログラムの支援を受けて,ルール大学ボーフムとの国際共同研究として行われました。
参考URL
大阪大学 蛋白質研究所 蛋白質結晶学研究室
http://www.protein.osaka-u.ac.jp/crystallography/LabHP/HOME.html
用語説明
- NDH様複合体
植物や藻類がもつ蛋白質複合体で,呼吸鎖のNADH脱水素酵素(NDH)に相同な部分があることからNDH様複合体と呼ばれる。金属中心として3つの鉄硫黄クラスターが分子内部に精巧に配置された膜蛋白質。チラコイド膜中のキノンを還元することで電子をチラコイド膜中に循環させる。
- チラコイド膜
光合成をおこなう植物や藻類がもつ光合成機能に特化した生体膜。多くの色素や膜蛋白質が規則正しく埋め込まれている。
- クライオ電子顕微鏡による単粒子構造解析
2017年のノーベル賞で注目された蛋白質の新しい構造解析法。試料ホルダーに薄い蛋白質の氷の層を作り,高性能電子顕微鏡で構造解析を行う。画像処理技術を駆使することで,原子分解能に到達することが可能である。
- X線構造解析
物質の構造を解析する手法の1つ。調べたい物質の結晶に対してX線を照射して、そこから散乱されたX線の強度を観測し解析することで最終的に結晶中の物質の構造を知ることができる。
