ナノシート上に集積型遺伝子回路ナノチップを創成
細胞を精密に制御し、医療応用に期待
研究成果のポイント
・ナノメートルサイズのシート上に、酵素と遺伝子を集積化した、集積型遺伝子回路ナノチップを開発
・1つのナノチップ上で検査と診断、応答物質のその場生産が完結、というコンセプトを試験管内で実証
・細胞の精密制御を実現する自律医療ロボットへの応用に期待
概要
大阪大学・蛋白質研究所・多田隈尚史助教、原田慶恵教授、東京大学大学院新領域創成科学研究科上田卓也教授、増渕岳也大学院生(現:東京大学定量研究所・プロジェクト研究員)、京都大学・理学部化学科・遠藤政幸准教授、杉山弘教授は、東京大学大学院薬学系研究科、船津高志教授、飯塚怜助教、早稲田大学ナノ理工学専攻・庄子習一教授らと、遺伝子回路の集積化に世界で初めて成功しました。
遺伝子を狙い通りにオン・オフできれば、医療等に有効であると期待されます。遺伝子回路は、周囲の環境に応じてどのように遺伝子をオン・オフするかを記述する技術です。そのため、複雑な遺伝子回路の設計ができれば、その時々の状況に応じて遺伝子のオン・オフを変えられるので、細胞の運命を精密に制御できると期待されます。しかし、従来の技術では回路の複雑度に限界がありました。これは、関与する因子(酵素や標的遺伝子)が溶液中を自由に漂いながら反応する従来の技術では、意図しない反応を完全には防げないという問題がありました (図1) 。本研究では、ナノメートルサイズのシートの上に、関与する因子を固定化し、シート上で反応が完結するようにしました(ナノチップ)。その結果、様々な種類のナノチップを混ぜ合わせるだけで、回路を構築できるようになり、設計自由度が向上しました。
今回は、試験管内での実証実験ですが、今後、細胞や個体内での検証が期待されます。本研究成果は、英国科学誌「Nature Nanotechnology」に、7月24日(火)午前0時(日本時間)に公開されました。
図1 集積化による効果
研究の背景
遺伝子回路は、合理的な設計を通して、遺伝子発現制御 をプログラム可能であるので、有用です。しかし、従来の遺伝子回路では、個々の因子が溶液を漂いながら自由に相互作用するので、非特異的相互作用を完全に排除することができず、意図しない反応が起きてしまうという本質的な問題がありました。
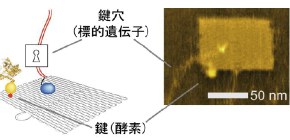
大阪大学多田隈助教、原田教授、東京大学上田教授、増渕大学院生(当時)、京都大学遠藤准教授、杉山教授らの研究グループでは、ナノメートル精度で分子の空間配置を制御できるDNAナノ構造技術 を用いて、遺伝子発現反応に関わる因子を集積化し (図2) 、因子間の距離とそれに伴う衝突頻度を制御することで、転写 反応(設計図であるDNAから、RNAを合成)の合理設計を実現しました。また、距離による反応制御の手法を応用することで、光照射による遺伝子回路の書き換えや、様々な物質材料由来のセンサーを用いた多種生物シグナルの検出・演算が可能となり、従来の生物材料のみを用いた遺伝子発現技術 と比べて設計自由度が向上しました。
図2 集積型ナノチップ(左:模式図、右:原子間力顕微鏡(AFM)像)
本研究成果が社会に与える影響(本研究成果の意義)
集積型ナノチップ上には、反応に必要な因子が全て揃っており、検出・演算・出力が1チップで完結しています(自律ナノチップ)。細胞の状況を検査・診断し、その場での応答物質生産が1チップ上で可能かどうかを試験管内で検証したところ、人工細胞を対象としたモデル実験に成功しました。今後、細胞や人工細胞の運命制御を通した医療への展開・貢献が期待されます。
特記事項
本研究成果は、2018年7月24日(火)午前0時(日本時間)に英国科学誌「Nature Nanotechnology」(オンライン)に掲載されました。
タイトル:“Construction of integrated gene logic-chip”
著者名:Takeya Masubuchi, *Masayuki Endo, Ryo Iizuka, Ayaka Iguchi, Dong Hyun Yoon, Tetsushi Sekiguchi, Hao Qi, Ryosuke Iinuma, Yuya Miyazono, Shuichi Shoji, Takashi Funatsu, *Hiroshi Sugiyama, Yoshie Harada, *Takuya Ueda, and *Hisashi Tadakuma
*:責任著者
なお、本研究は、科学研究費補助金(新学術領域研究”分子ロボティクス(#15H00798, 24104002)”、”ノンコーディングRNAネオテクソノミ(#26113007)”、若手研究A、基盤研究B、挑戦的萌芽研究(#24687018,16KT0068, 15K14485)、特別研究員奨励費(#15J08491)等)、科学技術振興事業団(JST)(CREST(#JPMJCR1333)、COI)、等の研究の一環として行われ、旭硝子財団、双葉電子財団、浜口生化学財団の御支援を得て行われました。
研究者のコメント
20世紀に電子回路が大きく発展し、スマホが行き渡り、AIが進化しました。遺伝子回路もより複雑な処理をより高速に実現できれば、細胞の運命制御を通して、iPS細胞等の再生医療や、癌のような病気の予防等の高度な処理が可能になり、”治療から予防へ”という医療の質的転換を具現化すると期待されます。
参考URL
大阪大学 蛋白質研究所 蛋白質化学研究部門 蛋白質ナノ科学研究室
https://www.ccc.osaka-u.ac.jp/protein/nanobiology/
用語説明
- 遺伝子発現制御
設計図(遺伝子)から、どの部品を、いつ、どれ位作るのかを制御すること。
- DNAナノ構造
DNA(デオキシリボ核酸)は4種類の塩基からできたひも状分子です。この塩基情報を用いて、ひもを上手く折りたたむとナノメートル(ナノは10億分の1)サイズの構造物を作製することができます(DNA折り紙技術。1982年に米国のNadrian Seemanによって提唱された技術を、2006年に米国のPaul W. K. Rothemundが発展させました)。本研究では、幅90nm、奥行60nm、高さ2nmのシート構造を用いました( 図2 。高さはDNA1本分の太さ)。
- 転写
設計図(DNAでできた遺伝子)から、必要な部分をRNA(リボ核酸)にコピーする操作。
- 従来の生物材料のみを用いた遺伝子発現技術
通常の転写制御では、酵素(鍵)が標的遺伝子(鍵穴)に結合する頻度を、制御因子(レギュレーター)が鍵穴を整えたり(転写促進)、塞いだり(転写抑制)することで制御します。このため、制御因子も鍵穴に結合できる物質である必要があります。一方、本研究では、キーチェーンや、固定点間距離で転写反応を制御しているので、キーチェーンの材質として様々な物を利用可能です。より専門的には、転写で用いられる酵素(RNAポリメラーゼ、以下RNAP)は、鍵穴(標的遺伝子。より正確には、プロモーター配列と呼ばれる部分)に結合し、転写反応を開始させます。レギュレーターは、プロモーター配列前後にある制御配列に結合し、RNAPの結合を促進したり阻害したりします。RNAPは、転写の際に制御配列の上も通過するので、一般的には、制御配列はRNAPが通過できる物質(この場合はDNA)である必要があります。また、レギュレーターは、一般的には、DNA結合因子である必要があります。一方で、本研究では、プロモーターとその下流にある遺伝子部分と、転写反応を制御するキーチェーン部分が分離しており、キーチェーンの材料は、必ずしもRNAPが通過できる物質(DNA)である必要はなく、硬さや実効長がシグナル認識によって変化するものであれば、どのような物質でも使用可能です。このことによって、様々なシグナルに反応する材料をセンサーとして用いることが可能となります。本研究では、DNA結合因子に加え、小さなRNA、低分子化合物、光(UV光)をシグナルとして用いることができました。
