血管内皮細胞内で細菌が増殖するメカニズムを解明
血管の細胞はオートファジーによる細菌の除去が苦手?
研究成果のポイント
・オートファジーによる細胞内の細菌除去が血管内皮細胞では起こらないことを発見。
・これは細菌を識別するシステムの問題であり、潜在的に細菌を分解する能力は備わっていた。
・血管内皮細胞のオートファジーを標的とした、新しい感染症治療の研究開発が望まれる。
概要
大阪大学のShiou-Ling Lu研究員、川端剛特任助教(大学院医学系研究科遺伝学)および吉森保教授(大学院生命機能研究科細胞内膜動態学/大学院医学系研究科遺伝学)らの研究グループは、血管の内皮細胞 についてオートファジー による細菌の除去ができないため、細胞内で細菌が増殖してしまうことを発見しました。あらかじめ感染させる細菌をユビキチンというタンパク質でコーティングすると、細菌は血管内皮細胞の中でもオートファジーによって除去されたため、血管内皮細胞にはオートファジーにより細菌を除去するための潜在的な能力が備わっていることが分かりました。今後、血管内皮細胞で細菌に特異的なオートファジーを誘導する方法を開発し、新たな感染症治療法につなげることが期待されます (図1) 。
本研究成果は、7月7日(金)午前3時(日本時間)に米国科学誌「PLOS Pathogens」にオンライン公開されました。
図1 血管内皮細胞内で細菌が増殖する仕組みの概要
血管内皮細胞では、侵入してきた細菌がうまく認識されず、オートファジーによって分解できない。あらかじめ細菌をユビキチンで標識すると血管内皮細胞でも細菌が分解できたため、新しい感染症の治療法の開発が期待される。
研究の背景
昨年、大隅良典博士がノーベル医学生理学賞を受賞されて大きく注目されているオートファジーは、自らの細胞内の構成成分を分解するしくみです。元々、オートファジーは栄養が足りない時にエネルギーなどを確保する経路として知られていましたが、近年になってオートファジーは損傷を受けたミトコンドリアなど様々な有害因子を選択的に分解し、細胞を助けていることが明らかになってきました。それは細胞内に侵入してきた細菌も例外ではなく、皮膚などの上皮細胞でオートファジーにより細菌を食べて殺していることが分かっていました。これをゼノファジーといいます。ヒトの体は様々な種類の細胞により作られていますが、上皮細胞以外でのゼノファジーについてはあまりよく分かっていませんでした。
今回、吉森教授らの研究グループは、細菌が血管内に入り込んで感染症が重篤化した時に細菌の感染のターゲットとなる血管内皮細胞にフォーカスをあてました。
本研究の成果
本研究グループは、A群レンサ球菌 などの様々な細菌をヒト培養細胞に感染させました。すると、これらは上皮細胞内では増殖しないにもかかわらず、血管内皮細胞では増殖が止まらずに細胞死を引き起こしました。電子顕微鏡で侵入した細菌の写真を撮ってみると、血管内の内皮細胞はオートファジーによる細菌の除去ができておらず、結果として細胞内で細菌が増殖してしまうことが分かりました。
細胞内に侵入した細菌にはユビキチンというタンパク質がくっつき、オートファジーの食べる目印になりますが、この標識が内皮細胞では上手く付いていませんでした。そこで、細菌をあらかじめユビキチンでコーティングしてから血管内皮細胞に感染させたところ、細菌はオートファジーによって除去されました (図2) 。
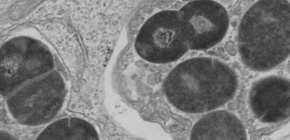
図2 A群レンサ球菌の血管内皮細胞内の電子顕微鏡写真
細菌をあらかじめユビキチンタンパク質でコーティングした後に感染させた。すると、細菌は血管内皮細胞の中でも矢頭で示したオートファゴソームによって包まれた。
本研究成果が社会に与える影響(本研究成果の意義)
研究グループは世界で初めて、オートファジーによる細菌の除去が血管内皮細胞では起こらないことを示しました。また、血管内皮細胞でもオートファジーによって細菌を除去する基本的なメカニズムを保持している証拠が得られたため、血管内皮細胞のオートファジーが感染症治療のターゲットとなりうることが分かりました。今後、なぜ血管内皮細胞内では侵入した細菌に目印となるユビキチンが付けられないのか、その詳細なメカニズムを解明して感染症の新しい治療法の開発につなげることが期待されます。
特記事項
本研究成果は、2017年7月7日(金)午前3時(日本時間)に米国科学誌「PLOS Pathogens」(オンライン)に掲載されました。
【タイトル】Endothelial cells are intrinsically defective in xenophagy of Streptococcus pyogenes
【著者】Shiou-Ling Lu 1 , Tsuyoshi Kawabata 2 , Yi-Lin Cheng 3, 4 , Hiroko Omori 5 , Maho Hamasaki 2 , Tatsuya Kusaba 1 , Ryo Iwamoto 1 , Hirokazu Arimoto 6 , Takeshi Noda 7,8 , Yee-Shin Lin 3, 9 and Tamotsu Yoshimori 1, 2*
1. 大阪大学 生命機能研究科 細胞内膜動態学
2. 大阪大学 大学院医学系研究科 遺伝学
3. Department of Microbiology and Immunology, College of Medicine, National Cheng Kung University, Tainan, Taiwan
4. Department of Biotechnology and Laboratory Science in Medicine, School of Biomedical Science and Engineering, National-Yang Ming University, Taipei, Taiwan
5. 大阪大学 微生物病研究所
6. 東北大学大学院生命科学研究科
7. 大阪大学 歯学研究科 口腔科学フロンティアセンター
8. 大阪大学 生命機能研究科
9. Center of Infectious Disease and Signaling Research, National Cheng Kung University, Tainan, Taiwan
(*責任著者)
なお、本研究は文部科学省科学研究費補助金および国立研究開発法人日本医療研究開発機構によりサポートされる研究の一環として行われ、東北大学大学院生命科学研究科 有本博一教授、大阪大学微生物病研究所の協力を得て行われました。また、本研究は台湾国立成功大学(National Cheng Kung University) Yee-Shin Lin 教授との国際共同研究の成果になります。
参考URL
大学院生命機能研究科細胞内膜動態研究室/医学系研究科遺伝学教室
http://www.fbs.osaka-u.ac.jp/labs/yoshimori/jp/index.html
用語説明
- オートファジー
細胞内に存在するタンパク質や構造体を二重膜で包み込み、ライソゾーム(多種の消化酵素をもつ細胞小器官)と融合することで包み込んだ内容物を分解する機構。オートファジーが開始すると、細胞質内に隔離膜が出現する。隔離膜は伸長して分解対象物を取り囲み、オートファゴソームを形成する。オートファゴソームはライソゾームと融合してオートライソゾームとなり、ライソゾーム内の消化酵素により分解対象物は分解される。オートファジーは、細胞内の不要物を分解することにより浄化作用を持つ。近年、様々な疾患においてオートファジーの機能が低下していることが確認されており、細胞内浄化作用が抑制され細胞内に不要物が溜まることが疾患の発症につながる可能性が考えられている。
- 血管内皮細胞
血管の最内面を構成する一層の細胞群。直接血液に触れるために血管内に細菌が侵入した際には感染に晒されるなど、血管内の変化を受ける。血管内皮細胞は一酸化窒素などを放出し、血管の収縮などを調節するなど循環器系の恒常性の維持に重要な役割を果たしている。
- A群レンサ球菌
A群レンサ球菌(GAS;Group A Streptococcus pyogenes):
グラム陽性の細菌で喉や皮膚に感染し、発熱と急性咽頭炎を引き起こす。治療には抗生物質が使われ、通常は軽度の症状にとどまるが、まれに免疫力の低下などにより体内の別の部分に感染が広がり、重症化して致死的になる恐れがある。米国では毎年10000人以上が重症化し、1000人以上が死亡する。
