異なる2つの神経難病、筋萎縮性側索硬化症と脊髄小脳変性症に共通した全く新しい治療標的を発見
本研究成果のポイント
・脊髄小脳変性症の1つであるSCA31は、異常なRNAくりかえし配列のRNA毒性によって起きることを見出しました。
・全く別の神経難病、筋萎縮性側索硬化症の原因となるタンパク質「TDP-43」は、SCA31の異常なRNAに結合するRNA結合タンパク質であることを発見し、さらにTDP-43がSCA31のRNA毒性を緩和するという画期的な発見をしました。
・一方、SCA31の短いRNAくりかえし配列は、逆に筋萎縮性側索硬化症においてTDP-43が凝集蓄積することによるタンパク質の毒性を緩和することを見出しました。
・以上のことから、正常な神経細胞の維持に、「RNA」とそのRNAを結合する「タンパク質」のバランスが重要で、脊髄小脳変性症や筋萎縮性側索硬化症ではこのバランスが破綻しており、これを補正することで両疾患の治療が可能になるという全く新しい概念を発表します。
東京医科歯科大学医学部附属病院 長寿・健康人生推進センター 石川欽也教授と東京医科歯科大学 水澤英洋特命教授・兼 国立精神・神経医療研究センター総長、大学院医歯学総合研究科脳神経病態学分野 横田隆徳教授の研究グループは、国立精神・神経医療研究センター神経研究所疾病研究第四部 永井義隆室長(現:大阪大学大学院医学系研究科神経難病認知症探索治療学寄附講座教授)、同和田圭司部長(現:同トランスレーショナル・メディカルセンター長)、ストラスブール大学、トロント小児病院などとの共同研究で、日本人特有と言われる遺伝性脊髄小脳変性症「SCA31」を引き起こす長いRNAくりかえし配列の神経毒性が、筋萎縮性側索硬化症(ALS)の原因蛋白であるTDP-43やFUS,hnRNPA2/B1によって緩和されることをつきとめました。逆にALSの原因となるTDP-43やFUS,hnRNPA2/B1の毒性は、短く毒性のないRNAくりかえし配列で緩和され、SCA31やALSの治療法開発に向けた画期的な発見をしました。この研究は科学技術振興機構戦略的創造研究推進事業(CREST)からの受託研究課題「プルキンエ細胞変性の分子病態に基づく診断・治療の開発」を筆頭とし、日本医療研究開発機構受託研究費(脳科学研究戦略推進プログラム、難治性疾患実用化研究事業)、ならびに文部科学省科学研究費補助金などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌 Neuron(ニューロン)に、2017年3月23日正午(米国東部時間)にオンライン版で発表されました。
研究の背景
脊髄小脳失調症31型(SCA31)は、日本人に特有と言われており、我が国には比較的高頻度存在する常染色体優性遺伝性の脊髄小脳変性症です。我が国には推定2,000人~4,000人程度の患者がいると考えられます。東京医科歯科大学は、この疾患の原因が患者にだけ存在するDNAの5塩基くりかえし配列であることを2009年に発見しました。また、SCA31患者の神経細胞には、5塩基くりかえしがRNAに転写され、異常な高次構造(RNAfoci)を形成していることを見出していました。タンパク質の凝集が根本現象となる神経疾患は以前から多数知られており、その代表としてアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などが挙げられますが、最近、SCA31と同じようにRNAの異常な凝集が原因となる神経難病も多数発見されています。(なお、タンパク質の凝集とは意味合いが違いますが、ここではRNA fociを「RNAの異常な凝集」と記載します)
研究成果の概要
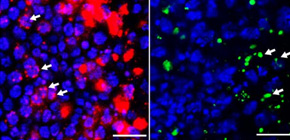
本研究グループは、SCA31由来の5塩基くりかえし配列DNAを導入した世界初のSCA31モデルショウジョウバエ を作製し、変異RNA(UGGAA)expの発現により、進行性の運動障害と複眼変性が生じることを明らかにしました (図1A、B) 。このショウジョウバエでは、患者脳と同様に異常なRNAの高次構造体RNA fociが検出され、また変異RNAからは「リピート由来の翻訳タンパク質(pentapeptide repeat:PPR)」も発現していることを発見し (図1C) 、RNA fociとPPRの両方がSCA31モデルショウジョウバエでの病態に関与していると考えられました。またこの変異RNAに結合するタンパク質を多数同定しましたところ、その中に筋萎縮性側索硬化症(ALS)の原因蛋白であるTDP-43,FUS,hnRNPA2/B1などが含まれることを発見しました。また実際に患者脳で認められるRNA fociにTDP-43が共局在することが確認されました。原子間力顕微鏡 やCD(円偏光二色性;Circular Dichroism)測定 などの解析により、TDP-43はSCA31のRNAくりかえし配列に結合しRNAの構造変化を引き起こすことが判明しました。そしてSCA31ショウジョウバエとTDP-43を発現する別のショウジョウバエを交配したところ、TDP-43の発現によりSCA31ショウジョウバエの複眼変性が修復され、組織中のRNA foci及びPPRの蓄積が減少し細胞毒性が緩和されたことから、TDP-43はRNAの構造異常を抑制するRNAシャペロン として機能することを見出しました (図2) 。逆に、変異を有するALSの原因タンパク質(変異TDP-43)を発現するALSモデルショウジョウバエに対しては、SCA31の変異RNAと同じ配列で毒性のない短いRNA(UGGAA)22の発現により変異TDP-43の凝集が抑制され、ALSモデルショウジョウバエの複眼変性が改善することを発見しました (図3) 。TDP-43だけでなく、FUSやhnRNPA2/B1を発現する、といった他のALSモデルショウジョウバエに対しても同様の変性抑制効果を認めました。
図1 SCA31モデルショウジョウバエの樹立
図2 RNAシャペロンTDP-43によりSCA31モデルショウジョウバエの複眼変性が改善し、RNA fociおよびPPRの蓄積が減少した
図3 短いRNAくりかえし配列により変異TDP-43を発現するALSモデルショウジョウバエの複眼変性が改善した
研究成果の意義
今回の研究結果は、RNAとRNA結合タンパク質との相互作用によりRNA結合タンパク質がRNAの構造異常を抑制する一方、RNAはRNA結合タンパク質の凝集を抑制するという生体内でのバランス機構の存在が示唆されました (図4参照) 。そして“このRNA/タンパク質のバランスの不均衡が、異常RNAの蓄積を認めるSCA31やRNA結合タンパク質の凝集を伴うALSを引き起こす”という新しい病態仮説を提唱するとともに、このバランスの不均衡を是正するという全く新しい治療手段の可能性を述べます。この成果は、各種RNAやRNA結合タンパク質が凝集蓄積する多様な神経変性疾患の創薬、治療戦略の足がかりとなることが期待されます。
図4 今回の研究の成果から生まれた概念図
~RNAとRNA結合タンパク質のバランスの不均衡により、SCA31やALSが発症する~
参考URL
医学系研究科 神経難病認知症探索治療学寄附講座
http://www2.med.osaka-u.ac.jp/neurother/
用語説明
- ショウジョウバエ
体長2~3mmの小型のハエで、遺伝学のモデル生物として長年用いられており、神経変性疾患のみならず癌や先天性疾患など多様な疾患モデルが樹立されています。遺伝学的解析に優れた性質を有し、遺伝学的修飾因子(増悪および抑制)スクリーニングに適しています。
- 原子間力顕微鏡
微細な探針と試料とに作用する原子間力を検出する顕微鏡です。原子あるいは分子というナノスケールの空間分解能を持ち、凹凸形状を三次元的に計測する手法です。
- CD(円偏光二色性;Circular Dichroism)測定
物質に直線光を当てた時に光が左右に偏る円偏光を測定する方法。遠紫外の波長領域のCDスペクトルから、核酸や蛋白質、ペプチドの二次構造、種類、含量などを予測する方法です。
- RNAシャペロン
RNAと結合してその構造を安定化させ、転写、翻訳、スプライシングなどに際しても重要な機能を果たすタンパク質のことです。
