治療抵抗型統合失調症の治療薬の作用機序の一端を発見
治療反応性を予測するバイオマーカーの開発に期待
本研究成果のポイント
・治療抵抗性統合失調症 のクロザピン反応性が異なる 一卵性双生児患者のiPS神経細胞由来分化神経細胞において、細胞接着 系分子群の患者間における発現量の相違を発見。
・治療抵抗性統合失調症に唯一有効な抗精神病薬であるクロザピンは、同症患者の約6割に有効であるが、これまでそのメカニズムは不明で、動物モデルでの研究では本疾患に対する研究が進展していなかった。
・今後、クロザピンの治療反応性を予測するバイオマーカー の開発や、将来的に治療抵抗性統合失調症に対する有効な新規治療薬の開発に資することに期待。
リリース概要
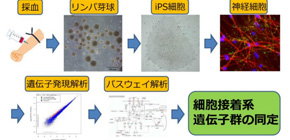
大阪大学大学院連合小児発達学研究科の橋本亮太准教授、同大学院歯学研究科の中澤敬信准教授、慶應義塾大学医学部の岡野栄之教授のグループは、治療抵抗性統合失調症のクロザピン反応性が異なる一卵性双生児患者の不死化リンパ球からiPS細胞由来分化神経細胞を作製し、クロザピン反応性の分子基盤として、細胞接着系分子群の患者間における発現量の相違を新たに発見しました (図) 。
治療抵抗性統合失調症に唯一有効な抗精神病薬であるクロザピンの有効性のメカニズムが不明であるとともに、副作用の問題もあり、クロザピンが十分に普及していない現状において、最先端の技術を用いてiPS細胞由来の治療抵抗性統合失調症患者神経細胞を作製し、クロザピン反応性の分子メカニズムの一端を見いだしたことは、精神医学領域や基礎医学/薬学領域において注目される成果です。
今後、今回発見した細胞接着系遺伝子群の発現量の相違が、クロザピン治療反応性の分子メカニズムの包括的解明の糸口となる可能性のみならず、クロザピンに対する反応性を予測するマーカーとなる可能性が考えられます。また、治療抵抗性統合失調症に対する有効かつ副作用の少ない新たな治療薬の開発が期待されるだけでなく、あらかじめ患者由来の神経細胞により治療反応性を予測でき、客観的診断法としても役立つことが期待されます。 なお、本研究成果は、国際的な学術専門雑誌「Schizophrenia Research」の電子版に11月4日(金)午前5時(米国東部標準時)に掲載されました。
研究の背景
統合失調症は幻覚・妄想、意欲低下、および認知機能障害等が認められる精神障害で、約100人に1人が発症する非常に頻度が高い疾患です。現存する治療薬を用いても充分に治療されない患者も多く、また主要な治療薬の副作用も大きな問題となっています。複数の抗精神病薬を、十分量、十分期間投与しても改善が認められない治療抵抗性統合失調症患者の存在も大きな問題です。
治療抵抗性統合失調症に唯一有効な抗精神病薬であるクロザピン治療は、治療抵抗性統合失調症患者の約6割程度に有効であることが知られておりますが、クロザピンには無顆粒球症 という致死的な副作用が、0.5-1.0%程度に認められており、クロザピンが十分に普及しない大きな原因の1つとなっています。また、クロザピンは複雑な薬理学的特性をもっているため、クロザピンの有効性のメカニズムは未だ不明です。
クロザピンの有効性のメカニズムを明らかにするためには、治療抵抗性統合失調症患者の神経細胞を用いた研究が重要でありますが、患者脳サンプルを研究に用いることはできないことから、現在までは、主に動物モデルや齧歯類の神経細胞を用いた研究が主流でした。しかし、治療抵抗性統合失調症に対する確立した動物モデルがなく、研究は進んでおりませんでした。
研究の内容
今回の一卵性双生児患者では、片方の患者は治療抵抗性統合失調症治療薬のクロザピンの投与で改善し、他方の患者においてはクロザピンの効果がありませんでした。一卵性双生児にも関わらず、明確に抗精神病薬に対する治療反応性に相違がある分子メカニズムを明らかにすることを目的として、両者の不死化リンパ芽球 からiPS細胞を作製し、神経細胞へと分化させました。得られたiPS細胞由来分化神経細胞から全RNAを調製し、遺伝子発現解析を実施しました。
その結果、クロザピンの効果が見られた患者では、効果がみられなかった患者と比較して、167遺伝子で高い発現が見られ、95遺伝子で低い発現が見られました。それらのトータル262遺伝子に関して、パスウェイ解析 を実施したところ、細胞接着関連の機能が推定されるグループに有意に濃縮されていることがわかりました。iPS細胞および分化神経細胞の作製に使用した患者の不死化リンパ芽球についても同じ解析を行いましたがその発現に同様な差異がありませんでした。
従って、本研究で明らかにした両患者間における遺伝子発現の差異は、iPS細胞由来分化神経細胞にのみ見られることがわかりました。
図 本研究の流れ。
患者の血液由来細胞からiPS細胞および分化神経細胞を作製し、遺伝子発現解析・パスウェイ解析を実施した。患者間で発現量に差異がある遺伝子として細胞接着系遺伝子群を同定した。
本研究成果が社会に与える影響
本研究成果により、細胞接着系遺伝子群の発現量の相違が、クロザピン反応性に関与していることが示唆されました。今後、クロザピン反応性に関与する分子メカニズムを包括的に明らかにするためには、他患者サンプルを用いた再現性を確認する研究等が重要になりますが、本研究により細胞接着系遺伝子群の発現量の相違が、患者のクロザピン治療反応性の分子メカニズムとなる可能性のみならず、クロザピンに対する反応性を予測するマーカーとなる可能性が考えられます。
すなわち、本研究により得られた成果は、治療抵抗性統合失調症に対する有効かつ副作用の少ない新たな治療薬の開発に貢献することが期待されるのみならず、あらかじめ患者由来の神経細胞により治療反応性を予測することが可能となり、客観的診断法としても役立つことが期待されます。また、(治療抵抗性)統合失調症の細分類化が可能となる、新たな系の開発に資することが期待されます。
研究支援
この研究は、国立研究開発法人日本医療研究開発機構(AMED)の障害者対策総合研究事業(精神障害分野) (平成27年度より厚生労働省から移管)「治療抵抗性統合失調症に対する客観的診断・治療法の開発」、「治療抵抗性統合失調症に対する客観的診断法及び実用的治療プロトコールの開発」、「精神疾患の病態を反映した鑑別診断、重症度予測が可能な血中バイオマーカーの実用化研究」の支援により行われました。
特記事項
大阪大学では、医学部附属病院神経科・精神科と薬学研究科神経薬理教室と歯学研究科で、基礎・臨床研究の融合研究を行う、Brain Phenotype HUBを運営しています。阪大病院におけるヒト脳表現型コンソーシアムの日本随一のバイオリソース・データベースと歯学/薬学研究科の精神神経疾患iPSセンターの技術が結びつくことにより、本研究成果が得られました。Brain Phenotype HUBは、国内外の100以上の研究機関と共同研究を行い、トランスレーショナルリサーチを推進しています。
参考URL
大阪大学大学院 連合小児発達学研究科HP
http://www.ugscd.osaka-u.ac.jp/
大阪大学大学院 歯学研究科HP
https://www.dent.osaka-u.ac.jp/
用語説明
- 治療抵抗性統合失調症
複数の抗精神病薬を、十分量、十分期間投与しても改善が認められない統合失調症患者。
- クロザピン反応性が異なる
今回の一卵性双生児患者では、片方の患者は治療抵抗性統合失調症治療薬のクロザピンの投与で寛解し、他方の患者においてはクロザピンの効果がなかった。
- 細胞接着
細胞同士が接着すること。神経細胞では、神経細胞の移動といった神経発達、神経細胞からの軸索誘導、あるいはシナプス形成等にとって必須。
- バイオマーカー
特定の疾患等において、生体の変化を定量化することを可能にする指標。
- 無顆粒球症
顆粒球(好中球)が、ほとんど認められない症状。生命が危機にさらされる。
- 不死化リンパ芽球
ヒト(患者)のリンパ球の一つであるB細胞をウイルス感染により不死化させたもの。活発な増殖能を持つので、研究によく使われる。
- パスウェイ解析
発現変動遺伝子がどの機能、代謝経路に関与しているのかを網羅的に調べる解析方法。
