心臓前駆細胞に特異的に発現する因子を発見
ES細胞/iPS細胞から心筋前駆細胞のみを取り出す方法を開発
本研究成果のポイント
・ES細胞/iPS細胞から心筋前駆細胞 のみを集める方法を開発
・これまで用いていたマーカーは特異的でなかったため、心筋前駆細胞のみを選別することは困難だった
・今後、ES細胞やiPS細胞から心筋細胞を誘導して用いる心筋再生医療の進展に期待
リリース概要
石田秀和特任助教(大阪大学大学院医学系研究科小児科学)、八代健太特任准教授(大阪大学大学院医学系研究科心臓再生医療学共同研究講座、元ロンドン大学クイーン・メアリ校バーツ・ロンドン医/歯学部ウイリアム・ハーベイ研究所上級講師)、大薗恵一教授(大阪大学大学院医学系研究科小児科学)らの研究グループは、心筋前駆細胞の目印となる細胞表面のマーカー(細胞表面抗原 )としてGFRA2を発見しました。GFRA2マーカーを用いることにより、ES細胞やiPS細胞から誘導して、心筋細胞になる前段階である「心筋前駆細胞」だけを、高純度に集めることが可能になりました。さらに、GFRA2がどのような役割をもつタンパク質かを調べた結果、機能に異常を来すと心筋緻密化障害と呼ばれる重度の心筋症の原因になりうることを動物実験で明らかにしました。
これまで心臓前駆細胞の選別に用いられていたマーカーは特異的でなかったため、心臓を構成するいくつかの細胞のうち、心筋細胞だけに分化する細胞を選別することは困難でした。
今後、心臓のパーツを作り出す心臓前駆細胞を取り出して調べることができるようになり、心臓が形作られる発生過程の研究等に大きく貢献できると考えられます。また、マーカーの組み合わせに多分化能を有する(様々な細胞に分化できる)心臓前駆細胞と、「心筋細胞だけに分化する」心臓前駆細胞を自由に区別して使えることにより、ES/iPS細胞を用いた薬剤試験ツールの開発や再生医療への応用が加速することが期待されます。
本研究成果は、7月26日(火)(米国東部時間)に「CellReports」に公開されました。
研究の背景
ES細胞やiPS細胞などのヒト多能性幹細胞を用いて心筋細胞を作製し、移植を行うことで効果的な治療を目指す、再生医療は大きな期待を集めています。また、患者さんのiPS細胞から作製した心筋細胞を用いて病気のモデルを作製することで、病態メカニズムの解明に加え、薬の効果を培養皿上で確認し、より効果的な薬の組み合わせを一人一人の患者に合わせて調整するといった、テーラーメード医療への応用も期待されています。しかし、これまでの心臓前駆細胞の選別に用いられていたマーカーは特異的でなかったため、心臓を構成するいくつかの細胞のうち、心筋細胞に分化する細胞のみを選別することは困難でした。
そこで研究グループは、マウスの心臓の初期発生に焦点を当て、マウス胚内で心臓前駆細胞が心筋に分化していく過程の遺伝子発現を調べることで、心筋細胞を選別するマーカーの同定を試みました。
本研究の成果
研究グループは、単一細胞レベル で次世代シークエンサー を用いて、マウスの心臓が形作られる過程における遺伝子発現の網羅的な解析を行いました。心臓前駆細胞に発現する細胞表面マーカーを探索した結果、神経栄養因子 受容体 タンパク質の1つであるGFRA2が、マウス胚の心臓前駆細胞に心筋へと分化する直前に特異的に発現し、心筋に分化すると消失することを見出しました。
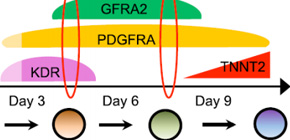
次に、研究チームは、マウスES細胞、ヒトES細胞及びヒトiPS細胞が心筋へ分化していく過程でのGFRA2遺伝子の発現を調べました。すると、マウス胚体内での発現と同じように、心筋細胞として自発的収縮を開始する直前に一時的にGFRA2は発現し、心筋細胞として分化した後には発現が消失することが分かりました。さらに、詳細にGFRA2陽性心筋前駆細胞の特徴を調べたところ、まず初期の頃の前駆細胞はGFRA2と共に、PDGFRA とKDR の3つを発現しており、心筋・平滑筋・血管内皮細胞に分化できる能力を有する一方、分化が進むとKDRの発現を失い、GFRA2とPDGFRAの二つのみを発現する前駆細胞になり、これは心筋細胞にしか分化することができない前駆細胞であることが明らかとなりました (図1) 。この結果を用いて、GFRA2を他のマーカー分子と組み合わせて目印にすることで、ES/iPS細胞から分化させた心筋前駆細胞を、以前よりも高純度に集められるようになりました (図2) 。
次に研究チームは、心臓発生におけるGFRA2が持つ役割を調べるために、Gfra2 遺伝子のノックアウトマウスを作製しました。するとGfra2遺伝子単独のノックアウトでは心臓に異常は生じませんでしたが、Gfra2のファミリー遺伝子であるGfra1 も同時にノックアウトするという、Gfra1/2二重ノックアウトマウスでは、重度の心筋症である心室緻密化障害 を生じる事が明らかになりました。
図1 ES/iPS細胞の分化誘導における細胞表面抗原(マーカー)の発現
図2 細胞表面抗原GFRA2の医学的有用性
細胞表面にあるGFRA2を目印にして、細胞選別機によって心臓前駆細胞を純化し取り出すことで、実験動物や人体を必要としない薬理試験や、心筋分化の基礎研究、組織工学と併用した再生医療を視野におくことが出来る。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、心臓前駆細胞に特異的に発現する細胞表面抗原(マーカー)が初めて明らかとなり、GFRA2に対する抗体と細胞選別機 により、遺伝子組み換え技術を使うことなく、ヒトやマウスのES/iPS細胞から心臓前駆細胞を高純度で単離できるようになりました。これにより、心臓のパーツを作り出す心臓前駆細胞を取り出して調べることができるようになり、心臓が形作られる発生過程の研究等に大きく貢献できると考えられます。 また、マーカーの組み合わせに多分化能を有する(様々な細胞に分化できる)心臓前駆細胞と、「心筋細胞だけに分化する」心臓前駆細胞を自由に区別して使えることにより、ES/iPS細胞を用いた薬剤試験ツールの開発や再生医療への応用が加速することが期待されます。
今後、大阪大学では、心臓再生医療学、心臓血管外科、循環器内科、小児科が協力し、この知見をiPS細胞を用いた再生医療応用の研究に更に発展させていく道を探索します。また、今回GFRA2の機能と関連することが分かった「心筋緻密化障害心筋症」の病理病態の更なる理解を深める研究も進めて行きます。
特記事項
本研究成果は、2016年7月26日(火)(米国東部時間)に、米国の科学誌「Cell Reports」に掲載されました。
掲載誌:Cell Reports (2016) Jul 26;16(4):1026-38.
論文タイトル:GFRA2 identifies cardiac progenitors and mediates cardiomyocyte differentiation in a RET-independent signaling pathway
著者:石田秀和 1,2 、佐波理恵 2,3 、Ioannis Kokkinopoulos 2 、橋本昌和 4 、山口修 5 、Sonja Nowotschin 6 、白石学 2 、Prashant Ruchaya 2 、Duncan Miller 2 、Stephen Harmer 2 、Ariel Poliandri 2 、小垣滋豊 1 、坂田泰史 5 、Leo Dunkel 2 、Andrew Tinker 2 、Anna-Katerina Hadjantonakis 6 、澤芳樹 7 、佐々木洋 4 、大薗恵一 1 、鈴木憲 2 、八代健太 2,3
1.大阪大学大学院医学系研究科小児科学
2.ロンドン大学クイーン・メアリ校バーツ・ロンドン医/歯学部ウイリアム・ハーベイ研究所
3.大阪大学大学院医学系研究科心臓再生医療学
4.大阪大学大学院生命機能研究科初期胚発生研究室
5.大阪大学大学院医学系研究科循環器内科学
6.ニューヨークメモリアルスローンケタリングがんセンター
7.大阪大学大学院医学系研究科心臓血管外科学
本研究は、主にMedical Research Council (MRC) New Investigator Reserarch Grant (G0900105)、MRC Research Grant (MR/J007625/1)の支援にて行われました。
参考URL
大阪大学大学院医学系研究科小児科学HP
http://www.med.osaka-u.ac.jp/~ped/www/Welcome-jp.html
用語説明
- 細胞表面抗原
細胞膜に存在するタンパク質で、そのタンパク質の一部が細胞の外側に露出している場合に、細胞表面抗原と呼ぶ。この抗原に特異的な抗体があれば、細胞を生きたまま細胞選別機(セルソーター)で集めることができる。
- 心筋緻密化障害
心室筋が、全層にわたって緻密な構造を形成せず、粗で間隙の多い非緻密化層を含むため、様々な程度の心機能障害を呈する心筋症。
- 心臓前駆細胞
中胚葉由来の細胞で、心臓を構成する細胞(主に心筋細胞、平滑筋細胞と血管内皮細胞)に分化することがすでに決まっているが、最終の分化はしていない未分化な細胞。
- 単一細胞レベル
単一細胞解析:
小さな細胞集団であっても不均質性が存在し、個々の細胞で、遺伝子やタンパク質の発現レベル等に差異があることから、1つの細胞からこれらを解析する技術の革新が進んでいる。
- 次世代シークエンサー
(Next Generation Sequencer:NGS):
遺伝子の塩基配列を高速に読み出せる装置。2003年のヒトゲノム解読に成功した国際プロジェクトでは、塩基配列の決定に13年かかっていたが、次世代シークエンサーを使用すると数日間で解析することができる。
- 神経栄養因子
神経細胞の分化、増殖や生存に必須の分泌タンパク質。
- 受容体
シグナル因子(増殖因子や分化誘導因子など)が結合するタンパク質で、タンパク質の立体構造が変化することで、細胞の応答を引き起こす。
- PDGFRA
(Platelet-derived growth factor receptor alpha):
血小板由来増殖因子(PDGF)に対する受容体。未分化中胚葉で広く発現している。
- KDR
(Kinase Insert Domain Receptor):
血管内皮細胞増殖因子(VEGF)に対する受容体。胚発生の初期では、血管内皮細胞だけではなく、血管細胞や血球細胞系に分化する能力を持つ血管芽細胞に発現している。
- Gfra2
GDNF受容体ファミリーに属する神経栄養因子Neurturinの受容体。これまで、初期の心臓や心臓前駆細胞で発現していることは知られていなかった。
- Gfra1
グリア由来神経栄養因子(GDNF; glial cell derived neurotrophic factor)の受容体。この受容体は進化的に良く構造が保存されているGDNF受容体ファミリーの一つ。
- 細胞選別機
(セルソーター):
一つ一つの細胞を小さい液滴内に閉じ込め、レーザー光を照射して蛍光と回折光を解析することで、標的とした細胞を選別し単離することができる装置。標的とする細胞だけを認識する蛍光標識された特異的な抗体があれば、目的とした細胞を純化して集めることが可能。
