外来遺伝子(DNA)の生細胞への効率的な導入方法の開発に成功
ガンや高血圧、糖尿病など特定の遺伝病を治療するための遺伝子治療に貢献
本研究成果のポイント
・p62 タンパク質の量を減少させることで、細胞内に導入したDNAの分解を抑制し、導入効率の上昇に成功
・オートファジー によって導入したDNAの大部分が分解されてしまうというこれまでの問題を解決
・細菌・ウイルス感染のメカニズムの解明や、ガンや高血圧、糖尿病など特定の遺伝子治療法の開発に貢献
リリース概要
国立研究開発法人情報通信研究機構(NICT、理事長:坂内正夫)未来ICT研究所は、国立大学法人大阪大学(大阪大学、総長:西尾章治郎)大学院生命機能研究科小川英知特任准教授、平岡泰教授らと共同で、外来DNAを生きた細胞に効率よく導入するために、p62と呼ばれるタンパク質の量を減少させることで、DNAの導入効率を上昇させることに成功しました。
これまでは、オートファジーと呼ばれる細胞に侵入した外敵を分解するシステムによって、導入されたDNAの大部分が核に運ばれる前に分解されてしまうという問題がありました。今回、オートファジーシステムの一員であり、DNAの分解に貢献するp62を除去することにより、細胞内のオートファジー機能が弱まりDNAが壊されなくなるため、遺伝子導入効率が飛躍的に上昇することが証明されました。

オートファジーの概念図

遺伝子導入の概念図
本成果は、分子細胞生物学分野の基盤技術として大きなブレークスルーとなると考えられます。また、ES細胞 を使った基礎医学分野及びガンや高血圧、糖尿病など特定の遺伝病を治療するための遺伝子治療に貢献できると期待されます。
なお、本研究成果は2016年6月18日に国際的科学誌「FEBS Letters」のオンライン速報版で公開されています( http://onlinelibrary.wiley.com/doi/10.1002/1873-3468.12262/full )。
背景
分子細胞生物学分野において、外来遺伝子を効率よく生細胞に導入する必要があります。これまで、細胞にDNAを導入する場合、その導入効率が低いことが問題になっていました。また、細菌感染やウイルス感染などの感染症の治療分野では、感染した細菌やウイルスのDNAが細胞内でどのように処理されるかが、長年にわたって不明のままとなっています。さらに、遺伝子治療の分野では、安全で高効率なDNAの細胞核導入技術の開発が待ち望まれている状況にありました。
生細胞への外来DNAの導入効率が低い原因は、細胞内にオートファジーと呼ばれる細胞に侵入した外敵を分解するシステムがあり、そのシステムにより導入されたDNAの大部分が核に運ばれる前に分解されてしまうことです。NICT未来ICT研究所においては、微小なビーズを生細胞に導入する技術を既に開発しており、この技術を用いて、大阪大学と共同で様々な動物細胞でオートファジー過程を蛍光顕微鏡で追跡することにより、生細胞への遺伝子導入効率の評価を進めてきました。
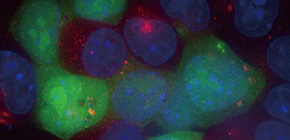
遺伝子導入された胚性幹細胞(緑色)
今回の成果
本研究では、情報媒体であるDNAを生きた細胞に効率よく導入するために、p62と呼ばれるタンパク質の細胞内量を減少させることにより、DNAの導入効率を上昇させることに成功しました。これまで、マウスのES(胚性幹)細胞では、DNAを導入しようとしても、その導入効率が悪いことが問題になっていました。それは、細胞にはオートファジーと呼ばれる、細胞に侵入した外敵を分解するシステムがあり、そのシステムによって導入されたDNAの大部分が分解されるからです。p62は、その分解システムの一員でDNAを分解することに貢献します。p62を除去すると、そのオートファジーの機能が弱まり、DNAが壊されなくなります。その結果、遺伝子導入効率 が上昇することを証明しました。
なお、本成果は2016年6月18日付けで、国際誌FEBSLettersにオンライン公開されております。また、本成果は、NICT未来ICT研究所と大阪大学大学院生命機能研究科との共同研究の一環として得られました。
今後の展望
今後、p62による外来DNAの分解機構の詳細を明らかにし、ES細胞と同様に多分化能を持ち再生医療に必要なiPS細胞の樹立に応用するとともに、生体における核酸医薬及びガンや高血圧、糖尿病など特定の遺伝病を治療するための遺伝子治療への応用を目指します。
論文情報
掲載誌: FEBS Letters
DOI: 10.1002/1873-3468.12262
URL: http://onlinelibrary.wiley.com/doi/10.1002/1873-3468.12262/full
掲載論文名: Depletion of autophagy receptor p62/SQSTM1 enhances the efficiency of gene delivery in mammalian cells
著者名: Megumi Tsuchiya, Hidesato Ogawa, Takako Koujin, Shouhei Kobayashi, Chie Mori, Yasushi Hiraoka, Tokuko Haraguchi
各機関の役割分担
NICT:ヒト培養細胞を用いた分子機構の解析
大阪大学:マウス胚性細胞を用いた遺伝子導入法の確立
補足資料
今回の成果の概要
本来、生物が細菌感染やウイルス感染を受けた場合には、外から入ってきた“異物”を迅速に捉えて適切に処理することが、生物の生存に極めて重要なことです。細胞におけるその機能をオートファジーと呼びます。一方、遺伝子治療を行う場合や効率よく遺伝子改変を行いたい場合には、用意したDNAを人工的に細胞内に入れる必要があります。これまで、DNAが細胞内に入ってきた時に細胞がどのように応答するかについては、ほとんど明らかになっていませんでした。今回の発見で、細胞内のp62タンパク質が異物であるDNAを捉えて速やかに分解するという極めて重要な役割を持っていることが判明し、p62タンパク質を一時的に減少させることで細胞に導入したDNAの分解を抑制でき、遺伝子導入効率を飛躍的に上昇させることに成功しました。
我々は、遺伝子が細胞内に導入され核に届くと緑色蛍光タンパク質(GFP)を強制的に発現する人工DNAを用いて、正常マウスの正常線維芽細胞及びp62タンパク質を遺伝的に欠損するマウスから樹立したp62欠損線維芽細胞に遺伝子導入し、GFP発現細胞の数を顕微鏡下で比較しました (図1参照) 。遺伝子導入後24時間で、GFPの発現がp62欠損線維芽細胞で非常に良いことがわかります。パネル上段の白い像がGFPを発現した細胞です。
図1 マウス繊維芽細胞の遺伝子導入効率の比較
このように、p62がない細胞では明らかに遺伝子導入効率が高いことが判明したことから、次に、p62タンパク質を一時的に減少させる手法(siRNA法)を用いて、p62を減少させた場合に遺伝子導入効率を上昇させることができるかどうかを検討しました。一般的に、遺伝子改変マウスの作製に用いられるマウス胚性幹細胞(マウスES細胞)は、遺伝子の導入が困難なことが知られています。もし、この細胞に効率よく遺伝子導入をすることができれば、これまでに必要とされていた多量の試薬や培養器具及び研究時間を大幅に削減することが可能です。
そこで、まず初めにマウスES細胞のp62タンパクをsiRNA法によって一時的に減少させました。そして、この細胞に先ほど用いたGFPを強制的に発現するDNAを遺伝子導入し、GFPの発現を顕微鏡下で確認しました。その結果、p62の減少していない正常ES細胞又はコントロールES細胞と比較すると、p62を減少させたES細胞でGFPの発現が明らかに強くなる結果が得られました (図2参照) 。すなわち、多分化能を持つ胚性幹細胞(マウスの母体内ではES細胞から個体に発生分化できる)に、非常に簡便な方法で飛躍的に遺伝子導入効率を上昇させることに成功したといえます。この胚性幹細胞は、通常の培養細胞と比べて、より生体内の個々の細胞と似通った性質を維持していることから、この手法が生体への応用が可能であることを強く示唆します。
図2 マウス胚性幹細胞の遺伝子導入効率の比較
次に、この手法が、細胞質で起きるDNAの分解反応を起きにくくしていることを分子的に証明するために、細胞に取り込まれたDNAを明確に可視化する目的で、DNAとビーズを人工的に接合したDNAビーズを作製して顕微鏡下で実験を行いました。このDNAビーズが細胞内に取り込まれると、数分でビーズ周囲DNAにBAFと呼ばれる細胞質タンパク質が集まります。このことによって、ビーズ(DNA)が細胞内に侵入したことが分かります。 図3上段 のコントロール細胞、つまり正常にp62タンパク質が存在する細胞では、p62がこのDNAビーズの周りに集結し、オートファジーマーカーであるLC3タンパク質が集まる様子が観察されました。一方、siRNA法でp62タンパク質の細胞内量を減少させた細胞 (図3下段参照) は、顕著にDNAビーズの周囲にオートファジー因子が集まりにくくなることがわかりました。
図3 DNAビーズのp62依存的なオートファジー
以上の結果から、細胞の中にp62がない状態ではDNAはオートファジーの攻撃を受けにくくなり、遺伝子導入されたDNAは分解されずに核内に移行すると考えられます。その結果として、これまでに見られたような遺伝子導入効率の著しい亢進が観察されます。
今回の発見は、細胞外から侵入したDNAが細胞質内で受ける扱いを分子レベルで明らかにしたものです。オートファジーは、細菌感染では細胞内免疫として働くと考えられていましたが、DNAが細胞質内に侵入した場合には核膜構造を作ることによって、オートファジーを回避し得ることが分かりました。
ウイルス感染の治療を目指す場合には、人為的に外来DNAを排除することが求められます。一方、遺伝子治療の場合には、人為的に外来DNAを細胞核内に伝送することが求められます。いずれの場合であっても、細胞の性質を正しく理解する必要があります。今回の発見は、安全・安心な感染症治療・遺伝子治療、高効率な遺伝子デリバリーを実現する上で有用な知見を提供するものです。
今回発見した仕組み
図4 細胞内にDNAビーズを入れた際の細胞内反応
左:p62がある場合,右:p62がない場合
図4は、細胞内にビーズを入れた時の細胞内反応を表したものです。 図4左側は、p62がある通常の細胞にDNAビーズを入れた場合です。DNAビーズが細胞内に取り込まれると、p62分子がDNAビーズの周りに集結します。その後、オートファジー因子が集合し、オートファゴソームが形成されます。 図4右側は、細胞内のp62タンパク量を減少させた細胞の場合です。DNAビーズが細胞内に入ったとき、オートファジー膜が集合し、オートファゴソームの形成が起こらないために、分解経路にDNAが運ばれることがなく、そのままDNAは細胞にとどまり核へ移動します。
参考URL
大阪大学大学院 生命機能研究科 細胞ネットワーク講座(平岡研究室)HP
http://www.fbs.osaka-u.ac.jp/labs/hiraoka/index.html
用語説明
- p62
プロテイン分子量62キロダルトン(別名SQSTM1/Sequestosome1/A170):
p62タンパク質は、細胞外の環境の変化(酸素の濃度や栄養状態)を感知して、不必要なタンパク質をオートファジーで分解して、細胞が環境の変化に対応できるように準備する役割がある。ウイルスや大腸菌などと同じように、外来のDNAは細胞にとって異物と見なされ、p62は、それらを認識してオートファジーで分解するために働く。
- オートファジー
オートファジーは、細胞が飢餓状態(アミノ酸欠乏)に陥ると、“自分自身”(細胞質)を食べてアミノ酸の基となる窒素源を補充する仕組みから名付けられた。しかし、現在では、細菌やウイルスが細胞内に侵入した時に、それらを攻撃する細胞内免疫としても考えられている。 オートファジーの仕組みを右図に示す。細胞内の一部をオートファゴソームと呼ばれる膜構造で覆い、リソソームと融合することで、オートファゴソーム内に閉じ込めた細胞質成分を分解する。
- 遺伝子導入効率
外来のDNAが細胞外から導入される効率を意味する。一般的には遺伝子が入った細胞と入っていない細胞とを識別するために、遺伝子が導入されると細胞が光る、又は染色されるなどの仕組みを持ったDNAを使用し、遺伝子導入された細胞数を比較する。本研究では、遺伝子が細胞内に導入されると蛍光を発するタンパク質(GFP)が作られる仕組みを持つDNAを導入することにより、遺伝子導入効率を評価した。
- ES細胞
胚性幹細胞(Embryonic Stem cell)のこと。動物の受精卵が発生する初期段階に現れる胚盤胞の内部細胞塊から作られる幹細胞で、あらゆる組織に分化する能力を持つ細胞群。
