世界初!マウス実験モデルを確立 金属アレルギー発症原因の解明に光
予防・治療法の開発、安全な金属ナノ粒子の開発に貢献
本研究成果のポイント
・金属アレルギーは、身近な疾患である一方、その疾患発症メカニズムの解明が遅れていた
・これまで原因と考えられてきた金属イオンではなく、生体内外で自然発生する金属ナノ粒子が引き金となり発症し得ることを解明し、金属アレルギーのマウス実験モデルの確立に成功
・本モデルを用いた、金属アレルギーの発症メカニズムの解明や、予防・治療法の開発のみならず、安全な金属ナノ粒子の開発にも貢献し得る成果
リリース概要
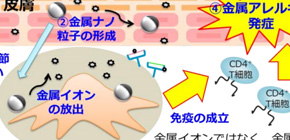
大阪大学大学院薬学研究科の平井敏郎博士後期課程3年生(研究当時 )、東阪和馬助教、吉岡靖雄准教授(研究当時 )、堤康央教授らの研究グループは、金属アレルギー発症において、これまで原因と考えられてきた金属イオンではなく、この金属イオンが生体内外で凝集し、金属ナノ粒子とよく似た形状となり、これら粒子に曝露することが引き金となり発症し得ることを明らかとするとともに、金属アレルギーのマウス実験モデルの確立に初めて成功しました (図1) 。
なお、本研究成果は、英国の科学雑誌「Nature Nanotechnology」の電子版に5月31日(火)(日本時間0時)に掲載されました。
*現在、ピッツバーグ大学医学部研究員
**現在、微生物病研究所特任准教授
図1 金属ナノ粒子が金属アレルギーの発症原因である可能性
金属アレルギーの発症には、金属イオンではなく、金属ナノ粒子が引き金となり得ることを見出すとともに、ヒト金属アレルギー病態と一定の免疫学的共通性を有する金属アレルギーモデルを初めて確立した。
背景
金属アレルギー は、歯科領域や装身具の利用等でみられる、身近なアレルギー疾患の一つで、アレルギー性の接触過敏性皮膚炎 を主な症状とします。金属アレルギーは、身に着けたネックレスなどの金属から、汗などによって金属イオン が溶けだし、その金属イオンに曝露することで、直接的もしくは生体内分子と結合することで、病態が発症するものと考えられてきました。しかし、金属イオンを単にマウスに投与しても、金属アレルギーは発症せず、発症の原因が、単なる金属イオンの曝露ではないことも示唆されるなど、いまだ原因不明です。このような背景のもと、近年、金属から溶け出した金属イオンが再結晶化することで、金属ナノ粒子 が自然発生することが明らかとなってきました。本事実は、例えば、人工関節や装着したネックレスなどから金属イオンが溶け出し、金属ナノ粒子が自然発生することで、我々が日常的に金属ナノ粒子に曝露され得ることを示しています。そこで本研究では、金属アレルギーの原因金属であるニッケルや銀から構成される金属ナノ粒子を用い、金属ナノ粒子が金属アレルギー発症に及ぼす影響を評価しました。
本研究成果の内容
金属アレルギーでは、金属に曝露されることで金属に対する獲得免疫 が誘導され、再度曝露された際に、金属に対する免疫応答が活性化することでアレルギー病態が発症します。本実験では、あらかじめ金属ナノ粒子あるいは金属イオンを投与したマウスに、再度同じ金属ナノ粒子あるいは金属イオンを投与し、それぞれに対する炎症応答の悪化を指標として、金属ナノ粒子と金属イオンの金属アレルギー誘導能を比較検討しました。具体的には、粒子径が10nmの銀ナノ粒子や3nmのニッケルナノ粒子といった金属ナノ粒子、あるいは銀イオンやニッケルイオンなどの金属イオンを、免疫活性化剤である大腸菌由来リポポリサッカライド(LPS)と共にマウスに投与(前投与)しました。その後、耳に金属ナノ粒子あるいは金属イオンを投与し、耳の腫れをアレルギー応答の指標として、金属ナノ粒子あるいは金属イオンの金属アレルギー誘導能を評価しました。その結果、金属イオンではなく、金属ナノ粒子を前投与したマウスでのみ、金属ナノ粒子、金属イオンのいずれによる耳の腫れも有意に増強されました (図2) 。従って、金属ナノ粒子の前投与により、金属に対するアレルギー応答が増強されることが明らかとなりました。
金属アレルギーを含むアレルギー性の接触皮膚炎は、一般に、T細胞 などの免疫細胞の関わる獲得免疫応答によって誘導されることが知られています。そこで、種々の免疫細胞を抗体で欠損させた場合のアレルギー応答を評価しました。その結果、CD4T細胞 を除去した場合にのみ、金属ナノ粒子の前投与による耳の腫れが減弱したことから、金属ナノ粒子の前投与はCD4 T細胞依存的な獲得免疫応答を誘導することが明らかとなりました。さらに、金属ナノ粒子を前投与したマウスの脾細胞を摘出後、培養した脾細胞に対し金属ナノ粒子および金属イオンで刺激したところ、いずれにおいてもIL-17Aが産生されていました (図3) 。そこで、IL-17Aに対する中和抗体を投与したところ、金属ナノ粒子によるアレルギー応答が減弱したことから、金属ナノ粒子により誘導されるアレルギー応答は、Th17性の免疫応答であることが明らかとなりました (図4) 。
ヒトの金属アレルギーにおいても、IL-17を産生するCD4 + T細胞であるTh17細胞が病態発症に重要であることが示唆されており、金属ナノ粒子によるアレルギー応答は、ヒトの金属アレルギー病態で観察される免疫応答に近く、金属アレルギーのマウス実験モデルの確立に成功したものと考えられます。また、イオン放出量の少ない金属ナノ粒子である金ナノ粒子、非金属である非晶質シリカ(二酸化ケイ素)ナノ粒子を用いて検討したところ、アレルギーは誘発されませんでした。従って、本実験系においては、金属ナノ粒子であることに加え、金属イオンを放出する作用を有することが、金属アレルギー発症に重要な働きをしていることが考えられました。
次に、なぜ、金属ナノ粒子は金属イオンとは異なり、アレルギー応答を誘導し得るかについてメカニズム解明を図りました。免疫誘導の場であるリンパ節への移行性を評価した結果、金属ナノ粒子は金属イオンと比較して、リンパ節へ高い割合で移行・滞留し、金属イオンに対するアレルギー応答を誘導することが明らかとなりました (図5) 。
以上、本研究では、金属アレルギーのマウス実験モデルの確立に成功し、①金属イオンではなく、生体内外で自然発生する金属ナノ粒子が発症の引き金となり得ること、②金属ナノ粒子がリンパ節へ多く移行し、金属イオンを放出する、即ち、金属ナノ粒子が金属イオンの送達媒体として作用することで金属アレルギーが発症し得ること、③金属アレルギーの病態がTh17依存的な病態である可能性など、金属アレルギー発症の新たな機序を提唱しました。
図2 マウスにおいて、金属ナノ粒子を投与することで、投与金属に対する強い特異的免疫応答が誘導される
銀ナノ粒子、あるいは銀イオンを、免疫活性化剤である大腸菌由来リポポリサッカライド(LPS)と共にマウスに投与(前投与)した。その後、耳に金属ナノ粒子あるいは金属イオンを投与し、耳の腫れの悪化をアレルギー応答の指標として、金属ナノ粒子あるいは金属イオンの金属アレルギー誘導能を評価した。その結果、金属イオンではなく、金属ナノ粒子を前投与したマウスでのみ、金属ナノ粒子、金属イオンのいずれによる耳の腫れも有意に増強された。*p<0.05, **p<0.01 vs. 溶媒前投与群; n.s., not significant
図3 金属ナノ粒子は、金属イオンに対するTh17性の免疫応答を活性化する
金属ナノ粒子を前投与したマウスの脾細胞を、in vitroにおいて、金属ナノ粒子および金属イオンで刺激したところ、いずれにおいてもIL-17Aが産生されることが明らかとなった。*p<0.05, **p<0.01; N.D., not detected
図4 銀ナノ粒子により誘導される獲得免疫応答を担う細胞群
CD4 + T細胞、IL-17Aに対する中和抗体を投与することで、金属ナノ粒子によるアレルギー応答が減弱したことから、金属ナノ粒子により誘導されるアレルギー応答の増強は、CD4 + T細胞依存的であり、とりわけ、Th17性の免疫応答であることが示唆された。**p<0.01 vs. コントロール抗体投与群
図5 金属ナノ粒子は金属イオンと比較して、高い割合でリンパ節に移行・滞留する
免疫誘導の場であるリンパ節への移行性を評価した結果、金属ナノ粒子は金属イオンと比較して、リンパ節へ高い割合で移行・滞留することが明らかとなった。**p<0.01
社会に与える影響
本研究では、金属から、金属イオンのみならず、金属ナノ粒子が自然発生するという報告に着眼し、金属ナノ粒子と金属アレルギー発症の関連を評価しました。その結果、マウスにおいて、金属ナノ粒子を投与することで、投与金属に対する強い特異的免疫応答が誘導されることが明らかとなりました。また、金属イオンと比較して、金属ナノ粒子は高い割合で所属リンパ節に移行・滞留したうえで、金属イオンを放出し、金属イオンに対するTh17性の免疫応答を活性化することで、金属アレルギーを誘導することが明らかとなりました。本結果は、金属アレルギー発症の機序に関する新たな仮説を提示するとともに、金属アレルギーのマウス実験モデルを供するものです。今後、金属アレルギー発症における金属ナノ粒子の寄与をヒトにおいて検証し、本モデルを用いた金属アレルギー病態の解明や、その治療や予防に重要な知見が得られることが期待されます。
また近年、100nm以下の素材である人工ナノ粒子の開発が世界規模で進んでいます。人工ナノ粒子は、100nm以上の従来までの素材よりも優れた機能を有することから、工業用製品・電化製品・日常生活用品・医薬品・食品など、様々な製品に応用され、生活の質の向上に寄与しています。一方で、人工ナノ粒子の安全性評価は未だ十分とは言えず、物性・品質をも加味した安全性情報の収集が急がれています。本研究成果は、金属アレルギーの病態解明に資する基礎研究としてのみならず、安全・安心な人工ナノ粒子の開発を促進するナノ最適デザイン研究としても意義深いものと考えられます。即ち、本研究成果を基に、金属イオンを放出しにくい人工金属ナノ粒子をデザインすることで、金属アレルギーの原因にはなり得ない、より高度に安全性が担保された人工金属ナノ粒子の開発に繋がるものと期待されます。人工的に合成したナノ粒子 の開発も進んでおり、安全な人工金属ナノ粒子の開発にも貢献し得るものと期待されます。
特記事項
本研究成果は、2016年5月31日(火)0時(日本時間)に英国科学誌「Nature Nanotechnology」の電子版に掲載されました。
タイトル:“Metal nanoparticles in the presence of lipopolysaccharides trigger the onset of metal allergy in mice”
著者名:平井敏郎、吉岡靖雄、和泉夏実、市橋宏一、半田貴之、西嶌伸郎、植村瑛一郎、佐上公一、髙橋秀樹、山口真奈美、長野一也、向洋平、鎌田春彦、角田慎一、石井健、東阪和馬、堤康央
また、本研究は、大阪大学大学院薬学研究科と、大阪大学微生物病研究所および医薬基盤・健康・栄養研究所との共同研究により行われました。
参考URL
大阪大学 大学院薬学研究科 毒性学分野HP
http://www.phs.osaka-u.ac.jp/homepage/b009/index.html
大阪大学微生物病研究所BIKEN次世代ワクチン協働研究所 ワクチン創成プロジェクト(吉岡グループ)HP
http://www.biken.osaka-u.ac.jp/lab/vaccine-cre/index.html
用語説明
- 金属アレルギー
金属が原因となって誘発されるアレルギー。ニッケルやコバルトなど、金属イオンになりやすい金属がアレルギーを引き起こしやすいことが知られているものの、その詳細は不明な点が多く残されている。
- 金属イオン
金属の原子から生じるイオン。銀イオン(Ag + )、銅イオン(Cu 2+ )、アルミニウムイオン(Al 3+ )などが存在する。
- 金属ナノ粒子
ナノ粒子のうち、組成が金属からなるもの。例えば、銀、金、白金、ニッケルナノ粒子などが挙げられる。
- 接触過敏性皮膚炎
金属や薬剤といった原因物質が皮膚に接触することで発症する急性皮膚疾患(日常生活では、「かぶれ」を指す)。症状としては、原因物質が接触した部分に発疹ができ、掻痒を伴う。金属アレルギーは、本皮膚炎の1つ。
- 獲得免疫
後天的に、外来異物の刺激(感染や予防接種など)により形成される免疫応答。
- T細胞
リンパ球の一種で、獲得免疫を担う中心的細胞の一つ。
- CD4T細胞
免疫系細胞の細胞表面に発現している糖タンパクであるCD4を発現した、T細胞の1つ。
- IL-17A
Th17性のサイトカインの一種。自己免疫疾患やアレルギー性炎症応答の発症において中心的な役割を果たす。
- Th17
サイトカインであるIL-17を産生するCD4 + T細胞の集団
- 人工ナノ粒子
一般に、物質を100nm(100nmは10 -7 m)の大きさに制御した粒子状物質を指す。近年、金属から溶け出した金属イオンから、金属ナノ粒子が自然発生することが知られている。また、人工的に合成したナノ粒子は、様々な産業分野で応用されている。
