光合成によるエネルギー変換装置の構築原理を実証
30億年変わらぬ蛋白質の立体構造を維持
本研究成果のポイント
・光合成蛋白質の基本構造は、すべての光合成生物において共通であることが明らかとなった。
・世界で初めて緑色イオウ細菌の光合成蛋白質の変異体を作成することに成功した。
・光合成蛋白質の構造原理を解明できたことで、人工光合成系の開発に貢献することが期待される。
概要
大阪大学大学院理学研究科の大岡宏造准教授は、立命館大学生命科学部の浅井智広助教、名古屋大学大学院理学研究科の加藤祐樹助教、野口巧教授らの研究グループとの共同研究により、光合成によるエネルギー変換装置の基本構造は普遍的であることを明らかにしました。高等植物や藻類の光合成で働く光合成蛋白質Photosystem I(PS I)は、太陽エネルギーを利用して炭酸固定等に必要な高い還元力(NADPH )を作り出します。このPSI蛋白質は約30億年前に誕生した緑色イオウ細菌 と呼ばれる光合成細菌のもつ光合成蛋白質から進化してきました。高い還元力を生み出すには、初期電荷分離反応 にとって重要なクロロフィルの2量体からなるスペシャルペア が必要です。約30億年もの長い進化の歴史においても、スペシャルペアを取り囲む蛋白質の構造は、ほとんど変化せずに維持されてきたことが分かりました。
また、緑色イオウ細菌の光合成蛋白質の構造的解析はこれまで進んでいませんでしたが、本研究グループで独自に開発してきた遺伝子改変技術を用いることで、世界で初めて変異蛋白質を創出することに成功しました。
本研究は光合成蛋白質の構築原理を解明した点において大きな意義があり、初期電荷分離反応を模した人工光合成系の開発に貢献することが期待されます。例えば電荷分離反応で生じた電子を効率的に取り出すデバイスの開発にもつながる可能性があります。
本研究成果は、2016年1月25日10時(英国時間)に英国の科学誌「Scientific Reports」電子版(Nature Publishing Group)に掲載されました。
研究の背景
太陽エネルギーを吸収した光合成蛋白質は、スペシャルペアと呼ばれるクロロフィルの2量体から高い還元力をもつ電子を放出することが知られています。これまで高等植物や藻類のPSI蛋白質の立体構造は原子レベルで明らかにされていますが、その祖先型である緑色イオウ細菌の光合成蛋白質の立体構造は不明のままです。両者の機能上の類似性を示唆するデータについてはすでに多くの報告がありますが、構造上の類似性を直接示すデータは全くありませんでした。
今回、アミノ酸配列の比較情報をもとに、緑色イオウ細菌の光合成蛋白質の688番目のロイシン と689番目のバリン (PscA-Leu688, -Val689)を、それぞれシステイン に置換した変異蛋白質(L688C, V689C)を創出し、フーリエ変換赤外分光法Fourier transform infrared spectroscopy(FTIR) を用いて解析しました。システインに含まれるチオール基(SH基) の伸縮振動は、FTIR法で容易に観測することが可能です。その結果、導入したシステイン残基はスペシャルペアであるクロロフィルと新たに水素結合のネットワークを形成し、PS I蛋白質のスペシャルペア周辺と同じ分子環境が再現されていました( 図1 、 2 )。
このことは、お互いのアミノ酸配列の類似性は極めて低いにも関わらず、光合成反応にとって最も重要な部位であるスペシャルペア周辺の蛋白質構造は進化のごく初めに決定され、その構造を大きく変化させることなく保存されてきたことを意味しています。
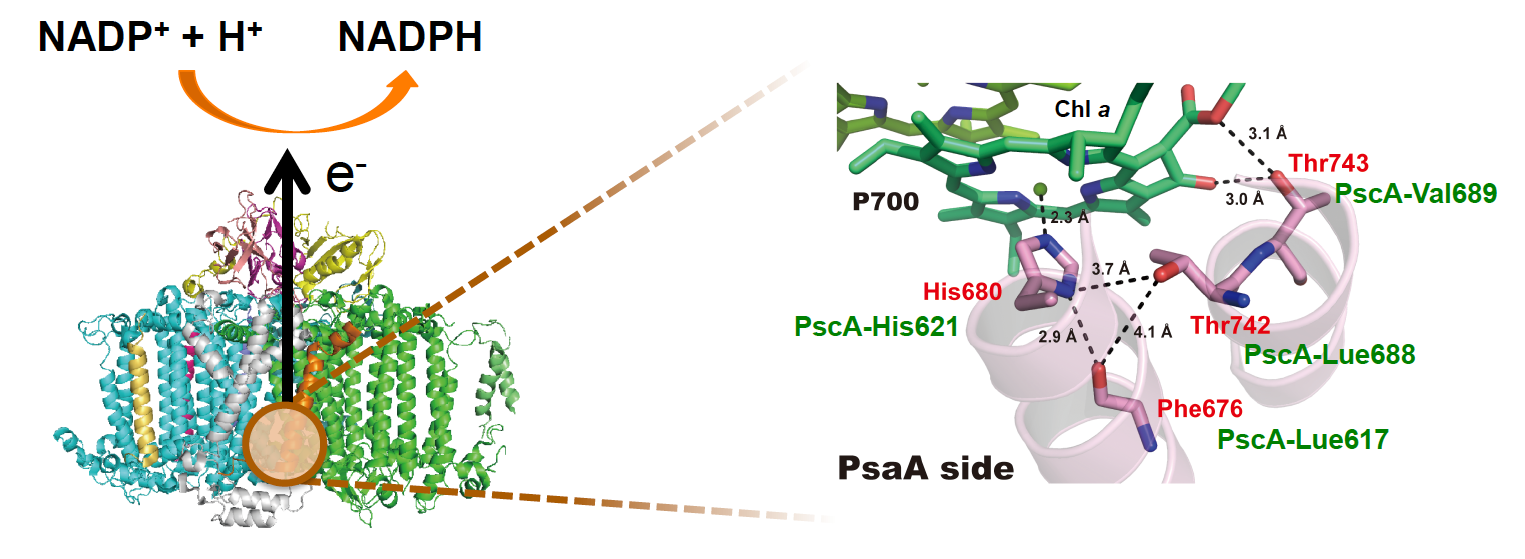
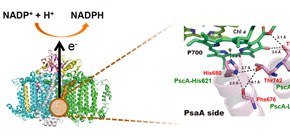
図1 高い還元力(NADPH)を生み出すPS I蛋白質の立体構造(左)。PSI蛋白質のスペシャルペア(P700と呼ばれるクロロフィル2量体)周辺の詳細構造(右)
スペシャルペアの片方が結合する側(PsaA side)のみを示す。アミノ酸配列の比較から、PSI蛋白質の各アミノ酸残基(Phe676, His680, Thr742, Thr743)は、緑色イオウ細菌の光合成蛋白質のアミノ酸残基(PscA-Leu617, -His621, -Leu688, -Val689)に対応すると推測された。このうちPscA-Leu688, -Val689をシステイン残基に改変したところ、FTIR法によりSH伸縮バンドとクロロフィルのケトC=Oのバンドシフトが検出され、PSI蛋白質の分子環境の再現に成功した。
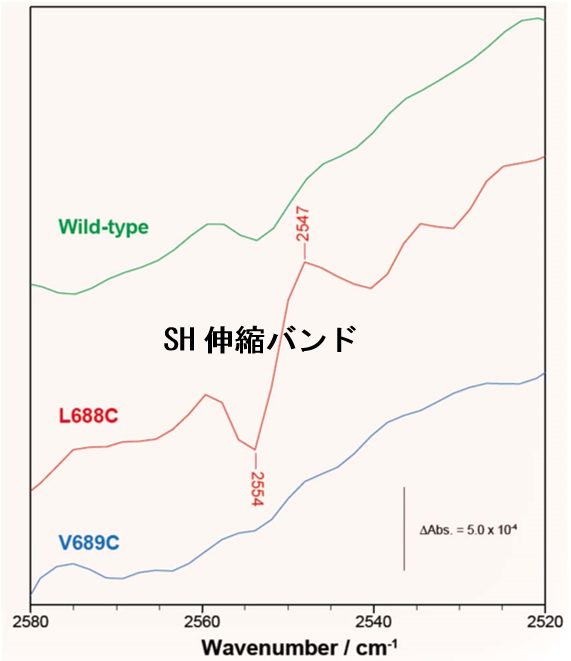
図2 緑色イオウ細菌の光合成蛋白質の688番目のロイシンと689番目のバリン(PscA-Leu688, -Val689)を、それぞれシステインに置換した変異蛋白質(L688C, V689C)の光誘起FTIR差スペクトル
L688Cで検出されたSH伸縮バンドは、スペシャルペアとの水素結合ネットワークが新たに形成されたことを示す。
本研究成果が社会に与える影響(本研究成果の意義)
緑色イオウ細菌の光合成蛋白質の構造的解析がこれまで進まなかった最も大きな理由の一つは、蛋白質を構成するアミノ酸残基を自由に改変できる手法が開発されていなかったことです。当該共同研究グループの大岡准教授と浅井助教が約10年かけて独自に開発してきた遺伝子改変技術を用いることで、世界で初めて変異蛋白質を創出することに成功しました。緑色イオウ細菌は光合成蛋白質が機能しなくなると死滅します。そこで変異蛋白質が機能しなくなっても生育できるように、もとの野生型蛋白質を残したまま変異遺伝子を細菌内に導入する工夫をしました。
本研究は光合成蛋白質の構築原理を解明した点において大きな意義があり、初期電荷分離反応を模した人工光合成系の開発に貢献することが期待されます。例えば電荷分離反応で生じた電子を効率的に取り出すデバイスの開発にもつながるかも知れません。さらに今後は、開発された技術を用いて緑色イオウ細菌の光合成蛋白質の構造的研究が大きく進展していくことも期待されます。
特記事項
本研究成果は、2016年1月25日10時(英国時間)に英国の科学誌「Scientific Reports」電子版(Nature Publishing Group)に掲載されました。論文タイトル:Mutation-induced perturbation of the special pair P840 in the homodimeric reaction center in green sulfur bacteria
著者:Chihiro Azai, Yuko Sano, Yuki Kato, Takumi Noguchi, Hirozo Oh-oka
URL: http://www.nature.com/articles/srep19878
本研究は、立命館大学生命科学部の浅井智広助教、名古屋大学大学院理学研究科の加藤祐樹助教、野口巧教授との共同研究です。本研究の一部は、日本学術振興会科学研究費補助金基盤研究(No. 25891025, 15H00886, 24570183, 15K07026, 24000018, 24107003, 25291033) の補助を受けて行われました。
参考URL
大阪大学大学院理学研究科生物科学専攻 大岡研究室
http://www.bio.sci.osaka-u.ac.jp/~ohoka/index.html
用語説明
- 緑色イオウ細菌
温泉などの硫化物が豊富な嫌気的環境に生息する光合成細菌。
- NADPH
細胞内の様々な生合成反応に必要とされる還元物質。PSI蛋白質から放出された電子により酸化型NADP + が還元されることで作られる。
- 初期電荷分離反応
太陽光で励起されたスペシャルペアは、隣接する一次電子受容体に電子を渡す。このときスペシャルペアは酸化型、一次電子受容体は還元型となる。この反応は光合成反応の初期過程であることから、初期電荷分離反応と呼ばれる。
- スペシャルペア
クロロフィルの2量体。太陽光で励起されることにより、還元力の高い電子を放出する。
- ロイシン
ロイシン、バリン、システイン、チオール基:
蛋白質は20種類のアミノ酸から構成されていて、それらが多様な順番(アミノ酸配列)でつながることで特定の機能を持つ蛋白質が出来上がる。緑色イオウ細菌の光合成蛋白質を構成する688番目と689番目のアミノ酸はロイシンとバリンで、これらを別のアミノ酸であるシステインにそれぞれ置換した変異蛋白質を創出した。システインはチオール基(SH基)と呼ばれる構造(イオウSと水素Hが結合した構造)を持つ。
- フーリエ変換赤外分光法
フーリエ変換赤外分光法(Fourier transform infrared spectroscopy(FTIR)):
分子の振動に由来する赤外光吸収をフーリエ変換方式で測定する分光法で、波数精度の高いスペクトルが得られる。蛋白質の微小な構造変化を検出するのに適している。
