細胞の分化状態の可視化に成功
ラマン散乱分光スペクトルによる“細胞指紋”の応用
リリース概要
理化学研究所(理研)生命システム研究センター先端バイオイメージング研究チームの市村垂生研究員、渡邉朋信チームリーダー、大阪大学免疫学フロンティア研究センターの藤田英明准教授らの共同研究チームは、ラマン散乱光 の分光スペクトル を用いて、細胞の分化状態を非染色かつ非侵襲で識別し、細胞分化の途中過程における細胞状態の変遷を可視化することに成功しました。
正常細胞とがん細胞との識別や良質な人工多能性幹細胞(iPS細胞) の仕分けなど、細胞の種類や分化状態を判断するために、近年では遺伝子やタンパク質発現・相互作用などの情報が主に使われてきました。しかし、これらの情報を得るためには、細胞を破砕するか、蛍光抗体 で染色する必要があります。このような従来の方法では細胞に損傷を与えてしまうため、細胞を損傷なく識別する方法の開発が待たれていました。
ラマン散乱は、物質に光を照射した際に、分子の固有周波数の光が散乱される現象です。細胞はさまざまな物質で構成されているため、細胞個々のラマン散乱スペクトルは、構成される物質の種類や含有比によって異なる可能性がありました。共同研究チームは、細胞の種類や状態を識別できる各細胞固有の情報を「細胞指紋」と呼び、これまでに細胞の種類や分化状態によって、ラマン散乱光の分光スペクトルが異なっていることを実測により確認し、それらを識別する数学的手法を開発しました。今回、この技術を用いて、胚性幹細胞(ES細胞) の初期分化、筋肉分化の過程におけるラマン散乱光の分光スペクトルを調べました。すると、分化途中過程は、分化前後にくらべて、細胞が不安定な状態であり、ラマン散乱光の分光スペクトルが座標上で「広く分布」することを発見しました。
この技術は、細胞に光を当てた時の散乱光を解析するだけで細胞の種類・状態を識別できる技術です。従来の方法のように細胞を破砕する必要がなく、蛍光抗体で細胞を染色する方法に比べても細胞に対する毒性が低いことが特徴です。また、顕微鏡技術を基盤としているため、単細胞精度での種類・状態識別が可能であり、iPS研究やがん細胞の判別診断のみならず、広い応用が期待できます。
本研究は、英国のオンライン科学雑誌『ScientificReports』(6月16日付け)に掲載されました。
研究背景
近年では、細胞の種類や分化状態を判断するために、遺伝子やタンパク質発現・相互作用などの情報が主に用いられています。これらの情報を得るためには、細胞を破砕するか、蛍光抗体などで染色する必要があり、計測対象となる細胞に損傷を与えてしまうという問題点がありました。一方で、細胞の種類を定義するだけなら、その細胞に特有の情報であれば何でも良いとも言えます。例えば、ヒト個人を識別するためには、そのゲノム情報を必要とはせず、指紋のみで十分です。私達は、細胞の種類や状態を識別できる「細胞指紋」というコンセプトを提案しています。
「指紋」となるには、細胞の状態を表す情報を含み、かつ、少ない物理パラメータである必要があります。本研究では、細胞指紋としてラマン散乱分光スペクトルに注目しました。ラマン散乱は、物質に光を照射した際に、分子の固有周波数の光が散乱する現象です。細胞が発するラマン散乱光の分光スペクトルは、細胞を構成する全ての分子振動の重ね合わせであるため、非常に複雑ではあるものの、構成物質の種類や含有比によって異なる可能性があります。共同研究チームはこれまでに、様々な用途に合わせて異なる細胞種間、あるいは、分化前後の細胞においてラマン散乱分光スペクトルが異なることを示してきました (図1) 。加えて、ラマン散乱分光スペクトルから複数の細胞種を区別する解析方法を考案し、ラマン散乱分光スペクトルが、細胞の種類や状態を識別するための細胞指紋として適用できることを示しました 注1) 。
注1 IchimuraT,ChiuL,FujitaK,KawataS,WatanabeTM,YanagidaT,FujitaH.Visualizing Cell State Transition Using Raman Spectroscopy. PLoSOne, 9:e84478,2014.doi:10.1371/ journal.pone.0084478.1
今回、共同研究チームは、この細胞指紋技術を用いて、細胞分化における細胞状態の変化を可視化することを試みました。
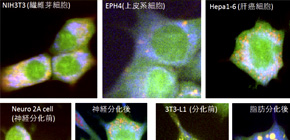
図1 様々な細胞株のラマン散乱分光画像
様々な細胞株のラマン散乱分光画像色の違いはスペクトルの違いを表している。細胞の種類、あるいは、細胞分化前後によって、細胞質や細胞核内の色が異なることが分かる。
研究手法と成果
ラマン散乱光は非常に微弱であるため、検出するためには、細胞に強い光を照射する必要があります。強い光は、細胞に損傷を与え、時に細胞を殺してしまいます。共同研究チームの藤田克昌准教授らは、この問題を解決し、生きた細胞のラマン散乱分光スペクトルを非侵襲で検出できる顕微鏡を開発しています 注2) 。共同研究チームは、このラマン散乱分光顕微鏡を用いて、筋肉分化モデル細胞株であるC2C12細胞を用いて、分化過程における細胞の状態遷移を経時的に追跡しました。
注2 OkadaM, SmithNI, PalonponAF, EndoH, KawataS, SodeokaM, FujitaK. Label-free Ramanobservation of cytochrome c dynamics during apoptosis. ProcNatlAcadSciUSA. 109:28-32,2012.doi:10.1073/pnas.1107524108.1
C2C12細胞は、培養ディッシュ上で培養を続けると、細胞分裂を繰り返し、ディッシュ底面が一面細胞で覆われます(Confluent)。その後、C2C12細胞は、筋分化が始まり長細い形へと変化し(Elongatedform)、最終的に、細胞は多核化し、筋管(Myotube)となります( 図2 上)。この分化過程において、細胞をラマン散乱分光顕微鏡で観察してみると、Confluent の状態になるまでは、ラマン散乱分光画像には変化が見られず、Elongatedformになって初めて変化が見られました( 図2 下)。Myotubeになると、ラマン散乱分光スペクトルは、さらに変化しました。この結果は、ラマン散乱分光スペクトルが、細胞分化の時間経過に伴って、変化していることを示しています。
図2 分化過程における細胞識別の一例(筋肉分化モデル)
C2C12細胞は、分化に伴い大きく形状を変化させる(上)。顕微鏡画像において、ピクセル毎に、ラマン散乱分光スペクトルを取得しているので、任意のスペクトルピークを用いて画像を作ることができる。下図では、シトクロムCを赤、蛋白質等に含まれるフェノール環を緑、脂質を青色で表している。色の違いが、ラマン散乱スペクトルの違いを表している。
しかし、これらのスペクトルの違いは、わずかであるため、従来の解析方法では、スペクトル間の相違を数値化することが困難でした。共同研究チームは、これまでに膨大な変数で表されたデータを、少ない数の独立変数に縮約して分析する方法である、主成分解析法を適用し、複雑なラマン散乱分光スペクトルを二次元または三次元の座標軸に投影する解析方法を開発してきました。この方法により、細胞の種類によるスペクトルの相違は、より明らかに可視化できるようになります。
上記の解析方法を用いて、細胞の分化過程における、各細胞のラマン散乱分光スペクトルを二次元座標上にプロットしました( 図3 上)。これは、単細胞精度でのラマン散乱分光スペクトルの存在分布を表しています。分化前と分化後の細胞は、この二次元座標上に、狭く分布していました。ところが、Elongationformと呼ばれる細胞の状態では、同座標上での分布が広くなっていました。これは、分化前後は、細胞の状態が安定であるのに対し、分化途中では、細胞が不安定であることを示しています。同様の現象は、ES細胞の分化初期過程においても確認されました。細胞が分化能力を持つときには、細胞内部状態が不安定になり、異なる細胞状態へと移行しやすくなり、分化と共に、その状態が安定していくと考えられます。
細胞の状態は、状態空間をめぐる球であると考えられます。細胞は自らの状態を変化させながら空間をめぐるのですが、その空間に大きな谷(アトラクター)があると、その谷から出ることができません。これが細胞の状態が安定している時です。一方で、細胞が分化する時には、現在の谷とは異なる谷まで移動する必要があります。すなわち、分化過程のように、ある状態の細胞が異なる状態に遷移する場合には、①現在ある谷が浅くなり、②異なる谷が出現すると考えられます( 図3 下)。今回の結果は、上記の過程を、ラマン散乱分光スペクトルを使って可視化できたと言えます。本研究結果は、ラマン散乱スペクトルを用いた細胞指紋法が、生命科学に広く適用可能であることを示すと共に、細胞分化が「状態ゆらぎ」によって引き起こされていることを示す証拠であると考えられます。
図3 ラマン散乱分光スペクトルの計測から得られた細胞状態のポテンシャル地形
ラマン散乱分光スペクトルの違いを識別するために、従来の解析では、スペクトルピークを用いていたが、本研究では、スペクトルの全情報を用いる主成分解析を採用した。これにより、スペクトル差が明確に可視化される(上)。二次元座標における存在確率密度から、細胞状態を表すポテンシャル地形を描くことができる(下)。赤丸は未分化状態のC2C12細胞のポテンシャルの谷(アトラクター)であり、青丸は分化後に出現した新しいアトラクターである。
今後の期待
分化多能性細胞由来の細胞・組織の医療応用を見すえた場合に、細胞分化の状態を蛍光マーカー等で標識することは好ましくなく、本手法のような非染色・非浸襲での細胞観察が望まれています。ラマン散乱分光スペクトルによる細胞の状態識別は、がんの画像診断や、がん摘出手術時のがん組織の識別などでも使用されており、少しずつ認知度が上がっている技術です。今後、本手法の再生医療の場での活用が期待されます。
論文情報
<タイトル>
Visualizing the appearance and disappearance of the attractor of differentiation using Raman spectral imaging
<著者名>
TaroIchimura, LiangdaChiu, KatsumasaFujita, HiroakiMachiyama, SatoshiKawata, TomonobuMWatanabe, HideakiFujita
<雑誌>
Scientific Reports
参考URL
用語説明
- ラマン散乱光
光を物質に入射すると、その一部が散乱される。そのほとんどは、入射光と同じ波長(レイリー散乱光)であるが、一部の光は、物質を構成する分子振動からエネルギーを得る、または、エネルギーを与えてから散乱することで、元の波長より短い、または、長い光が散乱する。この現象をラマン散乱現象と言い、その時の光をラマン散乱光と呼ぶ。1928年にインドの物理学者C. V.Ramanによって発見された。
- 分光スペクトル
光を波長または振動数の関数として表した強度分布関数である。光をプリズムに通したり回折格子に反射させたりすることで得られる。
- 人工多能性幹細胞(iPS細胞)
体細胞へ数種類の遺伝子を導入することにより、ES細胞(胚性幹細胞)と同等の分化万能性、および、自己複製能を持たせた細胞。現京都大学山中伸弥教授らの研究グループによって発明された。
- 蛍光抗体
蛍光色素によって標識された抗体。抗体を介して、任意のタンパク質を蛍光標識することができる。
- 胚性幹細胞(ES細胞)
動物の胚盤胞にある内部細胞塊より作られる幹細胞株であり、体を構成するすべての細胞に分化する能力、および、自己複製能を持つ細胞。
