ALS等で蓄積するタンパク質の分解メカニズムを解明
神経難病の治療法確立への貢献に期待
本研究成果のポイント
・著名人のアイスバケツリレーで脚光を浴びた筋萎縮性側索硬化症(ALS)や前頭側頭葉変性症(FTLD)などの脳脊髄組織に蓄積するTDP-43が、分解され細胞内からクリアランス(消去)される過程を詳細に解明。
・小胞体に局在するカスパーゼ4がTDP-43内部にある特定の部位を選択的に切断すること、またこの切断がTDP-43をクリアランスするための開始シグナルであることを発見。
・カスパーゼ4による切断活性を高めれば、TDP-43を介した神経毒性を軽減できることから、ALSやFTLDなどの神経変性疾患の新たな治療法の確立につながることが期待される。
リリース概要
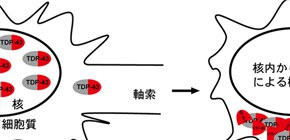
大阪大学大学院医学系研究科ゲノム生物学講座(神経遺伝子学)の河原行郎教授らの研究グループは、筋萎縮性側索硬化症(ALS)、前頭側頭葉変性症(FTLD)などの発症と密接に関連しているタンパク質TDP-43の詳細な分解メカニズムを明らかにしました。TDP-43は、43kDaのタンパク質で主に核に局在しています。しかし、ALSやFTLDでは、細胞質中に凝集し蓄積しています (図1) 。また、TDP-43は分解され、C末端側の25kDaの断片(CTF25)が顕著に蓄積していることも知られています。このため、細胞内局在の変化に伴うTDP-43の機能障害、細胞質中に蓄積することに伴う細胞毒性など、様々な要因がALSやFTLDの発症に関与すると考えられています (図1) 。しかし、断片の正確な切断部位、切断を担う酵素、更には断片化にどのような意味があるのかこれまで不明でした。
今回、本研究グループは培養細胞を用いて、CTF25の切断点が174番目のアスパラギン酸と175番目のシステインの間であること、このTDP-43の切断が小胞体に局在するカスパーゼ4と呼ばれる酵素によって触媒されることを突き止めました (図2) 。更に、この切断を阻止すると、TDP-43のクリアランス速度が著しく低下することを見出しました。このクリアランス速度の低下は、細胞内TDP-43量の増加を招き、細胞の恒常性が破綻することによって細胞死が加速することも分かりました。以上から、カスパーゼ4は、細胞内のTDP-43量を常に一定に維持するための監視役であり、カスパーゼ4による切断は、過剰になったTDP-43を分解してクリアランスを開始するためのシグナルになっていると考えられました (図3) 。今後カスパーゼ4の活性を高める薬剤の開発などを通してTDP-43の切断効率を高めれば、ALSやFTLDの新たな治療法を確立することにつながることが期待されます。
なお、本研究成果は、英国科学誌Nature Communicationsの電子版に1月29日(木曜日)午前10時(英国時間)に掲載されました。
研究の背景
ALSやFTLDなどに代表される神経変性疾患は、超高齢化社会の到来と共に、今後患者数が益々増加すると予測されています。しかし、一方で、病態解明と治療法確立が遅れており、根治可能な治療法は確立していないのが現状です。ALSは、運動神経細胞が変性し、全身の筋力が低下していく神経難病です。90%以上に遺伝性がなく、遺伝性のないケースでは、発症原因が不明です。しかし、ほぼすべてのALSにおいては、変性過程にある運動神経細胞の細胞質内に、TDP-43が断片化などの修飾を受けて凝集・蓄積していることが知られています。FTLDは、アルツハイマー病などとならぶ変性型認知症疾患の一種です。FTLDにおいても約50%程度の患者さんで神経細胞の細胞質にTDP-43が凝集・蓄積しています。また、頻度は稀ですが(ALS全体の0.1%以下)、TDP-43の遺伝子変異がALSやFTLDの患者さんで同定されており、TDP-43はALSやFTLDなどの神経変性疾患発症において中心的な役割を果たしていると考えられています。
細胞質に蓄積したTDP-43の一部は、断片であるCTF25です。また、培養細胞やマウスなどの動物にTDP-43を過剰に発現させるとCTF25が産生されます。このため、CTF25の産生が、TDP-43の凝集・蓄積を加速し、その結果神経変性を誘導するという考え方があります。一方で神経変性はTDP-43の凝集・蓄積以前から生じており、CTF25の蓄積は結果であり主因ではないとする考え方もあり、現在でも議論されています。こういった問題を解決するためにも、なぜTDP-43が切断されCTF25が産生されるか、その意味を明らかにする必要がありました。
今回、本研究グループは、TDP-43の切断点と切断を担う酵素カスパーゼ4を同定しました。これを突破口とし、カスパーゼ4の活性を阻害したり、切断点に変異を挿入して切断をブロックすると、TDP-43の細胞内からのクリアランス速度が著しく低下し、細胞死が加速することを見出しました。また、最終的にCTF25が蓄積するより前に細胞死が始まることも明らかになりました。これらの結果から、CTF25を産み出すカスパーゼ4による切断は、過剰なTDP-43が誘導する細胞死を回避するための防御反応であり、カスパーゼ4はTDP-43量を一定に保つための監視役を果たしていると考えられました (図3) 。
本研究成果が社会に与える影響(本研究成果の意義)
今後は、ALSやFTLDの脳脊髄組織でカスパーゼ4の活性にどのような変化が生じているのか明らかにする必要があります。何らかの理由でカスパーゼ4の活性が低下し、その結果TDP-43が過剰気味になっている可能性があります。逆に、翻訳が亢進するなどの何らかの理由でTDP-43が過剰気味となり、内在するカスパーゼ4の活性だけでは対応しきれない状態となっている可能性も考えられます。こういった解析を通して、神経変性疾患の根本的な原因が解決されることが望まれます。一方で、カスパーゼ4を補充したり、カスパーゼ4の活性を高めるような薬剤が開発できれば、ALSやFTLDの症状を軽減することも期待できることから、今後の神経変性疾患の新たな治療戦略の確立に一石を投じる成果だと考えられます。
特記事項
掲載誌:英国科学雑誌Nature Communications(1月29日付け:英国時間午前10時・電子版)
論文タイトル:The cleavage pattern of TDP-43 determines its rate of clearance and cytotoxicity
著者:Quan Li, Moe Yokoshi, Hitomi Okada, Yukio Kawahara
参考図
図1 TDP-43を介した細胞死誘導メカニズム
正常な神経細胞では、TDP-43は主に核に局在しているが、ALSやFTLDでは、細胞質中に凝集・蓄積し、角から消失する。この一部はC末端断片CTF25である。このため、TDP-43の機能障害や細胞質にTDP-43が蓄積することによる毒性獲得などにより細胞死が生じると考えられている。
図2 TDP-43のC末端断片の切断点(RRM:RNA結合モチーフ)
図3 カスパーゼ4によるTDP-43分解・クリアランスのメカニズム
小胞体に局在するカスパーゼ4は、細胞内のTDP-43量を監視している。1.TDP-43量が増加すると、CTF25を生み出す切断を開始する。産生されたCTF25の一部は凝集・蓄積し始める。2.活性化したカスパーゼ4は、下流のカスパーゼ3やカスパーゼ7、さらにはオートファジーやユビキチンプロテオソーム系など様々なタンパク質分解機構をさらに活性化し、3.TDP-43分解・クリアランスが加速する。最終的に凝集・蓄積したCTF25や過剰量のTDP-43は消失し、TDP-43量は正常化する。
参考URL
用語説明
- 筋萎縮性側索硬化症(ALS)
脊髄(下位)および大脳皮質(上位)にある運動神経細胞が変性し、全身の筋力が低下していく神経変性疾患。90%以上に遺伝性がなく、遺伝性のないケースでは、発症原因が不明である。運動神経細胞だけが選択的に障害される一方で、感覚や知能が保たれる。急速に進行するケースが多く、発症してから数年以内に呼吸不全となり、人工呼吸器などのアシストが必要になる。治療方法は確立していない。基本的には、中年期以降に発症する。日本には約9000人弱の患者がいる。
- 前頭側頭葉変性症(FTLD)
日本では、アルツハイマー型認知症、レビー小体型認知症に続いて3番目に多い認知障害を主症状とした変性疾患。原因は様々であり、一部に遺伝性がある。主に大脳皮質の神経細胞が変性する。以前から一部のALSに認知障害を呈する患者がいることが知られていたが、近年1つの遺伝子変異がALSとFTLDを併発させることが明らかとなった。その1つがTDP-43をコードした遺伝子の変異である。
- TDP-43
43kDaで、主に核に局在している。RNAと呼ばれる核酸に結合し、転写やスプライシングなどのRNA代謝を制御している。
- 小胞体
タンパク質の合成や分解の品質管理を行う細胞内器官。
- カスパーゼ
ヒトには11種類が同定されている。特定のアミノ酸配列中にあるアスパラギン酸を認識して、その後ろを切断する酵素である。一般にはアポトーシスと呼ばれるプログラムされた細胞死に関与する酵素として認知されている。この中のカスパーゼ4については小胞体に局在していることは知られていたが、具体的な機能については不明な部分が多い。
