パーキンソン病の治癒につながるか?!
原因物質アミロイド線維の基本的性質を解明
本研究のポイント
・パーキンソン病の原因となるアミロイド線維が、低温で完全に分解することを発見!
・このことで、今まで不明だったアミロイド線維の変性に関する基本的性質が明らかに。
・今後、パーキンソン病の予防や治療の発展に期待!
リリース概要
大阪大学蛋白質研究所後藤祐児教授のグループは、ハンガリーのエトヴァッシュ・ローランド大学、鳥取大学と共同で、パーキンソン病の原因となるアミロイド線維が、低温で完全に分解することを発見しました。アミロイド線維の変性に関する基本的性質が明らかになったことによって、パーキンソン病の予防や治療の発展につながることが期待されます。
アミロイド線維は、定常の単量体蛋白質が集まった不溶性の異常凝集体であり、パーキンソン病やアルツハイマー病などの様々な疾患を引き起こします。現在までにアミロイド線維形成機構や分解方法に関する詳細は不明でした。
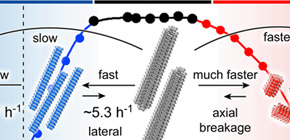
本研究では温度の変化に対して、アミロイド線維がどのような応答を示すのかを網羅的に調べました。球状蛋白質は生体内の温度から極端に高温、あるいは低温にすることで変性することが一般的に知られています。同様にアミロイド線維の場合でも高温や低温で変性(分解)を起こすことがわかりました。ここでアミロイド線維の変性とは線維を構成している蛋白質が分離して単量体になることをいいます。中でもパーキンソン病の原因となるアミロイド線維は、20℃という比較的穏やかな条件でも低温変性 を起こし、0℃では完全に低温変性することを見出しました。
なお、本研究成果はドイツ化学会誌(Angewante Chemie International Edition)の電子版に6月11日(水)に掲載されます。
研究の背景
蛋白質の異常凝集とアミロイド線維
生命機能を担う生の蛋白質は、フォールディング反応を通じて解けた鎖からコンパクトな立体構造を形成しています(天然状態) (図1) 。変性した不安定な蛋白質は、分子間で相互作用してゆで卵の白身のように凝集物を生成します。他方、変性した蛋白質がミスフォールディングしてアミロイド線維と呼ばれる幅が10ナノメータ-で長さが数マイクロメーターの針状の凝集物も形成します。アミロイド線維は、アルツハイマー病、プリオン病、透析アミロイドーシス、Ⅱ型糖尿病、ALアミロイドーシス、パーキンソン病など、30種類以上のアミロイド病と総称される病気の原因となります。蛋白質が変性して、一旦ほどけた鎖となり、これが次々と積み重なることによって、針状のアミロイド線維を形成することがわかってきています (図1) 。しかし、何故アミロイド線維が形成されるのか、形成した線維構造の安定性はどうなっているかなど、その詳細は不明でした。球状蛋白質の場合、構造の安定性や形成機構に関する様々な研究があり、温度変化による蛋白質の変性研究は網羅的に行われています。これに対してアミロイド線維の温度変化に伴う構造安定性の評価に関する報告例は非常に少なく、球状蛋白質の天然構造との比較は興味深い研究テーマです。
アミロイド線維形成は高温・低温変性を起こす
本研究グループでは、円偏光二色性測定や原子間力顕微鏡などを用いて、アミロイド線維の構造が0 - 110℃の範囲での温度変化でどのように変化するかを網羅的に調べました (図2) 。蛋白質としてパーキンソン病の原因となるαシヌクレイン(αSN)を初めとする6種類のアミロイド原性蛋白質を使用しました。その結果、すべてのアミロイド線維は60 ℃以上で蛋白質モノマーへと不可逆的に解離(高温変性)しました。このことから、高温における熱変性は蛋白質の種類によらず、アミロイド線維に一般的な特性であることがわかりました。一方、20 ℃以下の低温では興味深いことにαSNアミロイド線維のみが低温変性し、モノマーに可逆的に解離することがわかりました( 図3 、 図4 )。
αSNアミロイド線維の低温変性メカニズムの解明
上述の結果から低温での線維構造の安定性の低下は、構成する蛋白質のアミノ酸配列に依存的であることが示唆されました。そこでαSN線維の低温変性を支配する要因を特定するために変異体蛋白質との比較や等温滴定型熱量計による反応の熱量測定を行いました。その結果、αSN線維の低温変性を支配する要因が線維構造に埋もれる荷電残基にあることを明らかにしました。以上の網羅的実験から球状蛋白質とは異なるアミロイド線維の低温変性メカニズムを解明しました。
本研究成果が社会に与える影響(本研究成果の意義)
アルツハイマー病やパーキンソン病、糖尿病、白内障をはじめ高齢化社会の深刻な病気のほとんどにアミロイド線維が関わります。本研究では、アミロイド線維が温度変化によって解離することを示し、その現象を用いてアミロイド線維構造の安定化度合を評価しました。特にパーキンソン病の原因であるαSN線維は他の線維と比べて恒常性が高く、容易に正常な状態に戻すことが可能であることが示唆されました。線維の安定性を低下させる詳細な原因やメカニズムを理解することは、線維形成機構の理解や分解・除去の方法の開発につながり、アミロイド線維が原因となる病気の治療や予防が大きく進展すると期待できます。
発表論文
Tatsuya Ikenoue 1 , Young-Ho Lee 1 , Jozsef Kardos, Miyu Saiki, Hisashi Yagi, Yasushi Kawata, and Yuji Goto
1 These authors contributed equally to this work.
(池之上 達哉、李 映昊、Jozsef Kardos、齋木 美裕、八木 寿梓、河田 康志、後藤 祐児)
Cold Denaturation of Alpha-Synuclein Amyloid Fibrils(αシヌクレインアミロイド線維の低温変性)
参考図
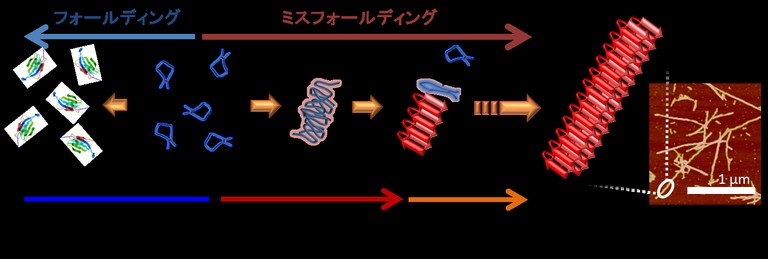
図1 蛋白質のフォールディングとアミロイド線維形成
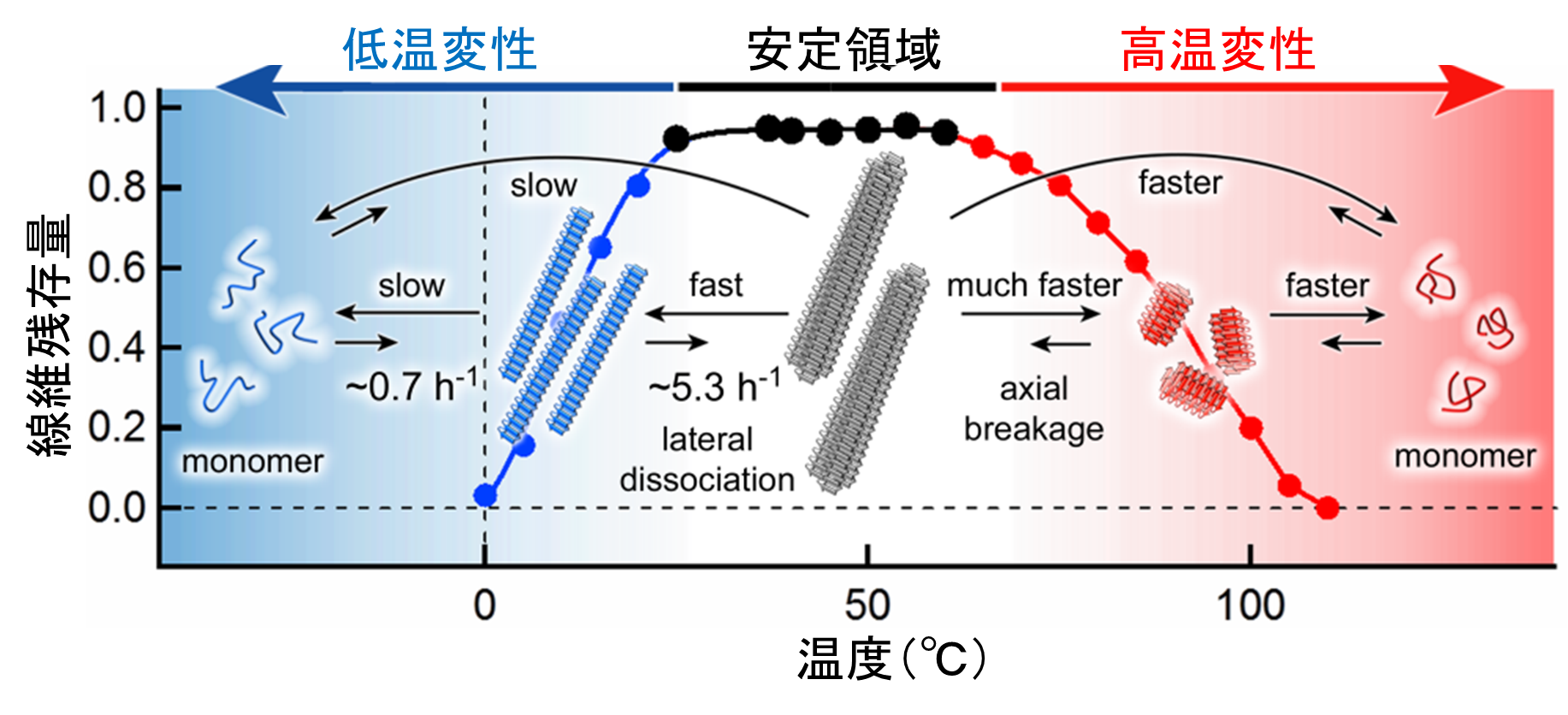
図2 αSNアミロイド線維形成の温度に対する構造安定性
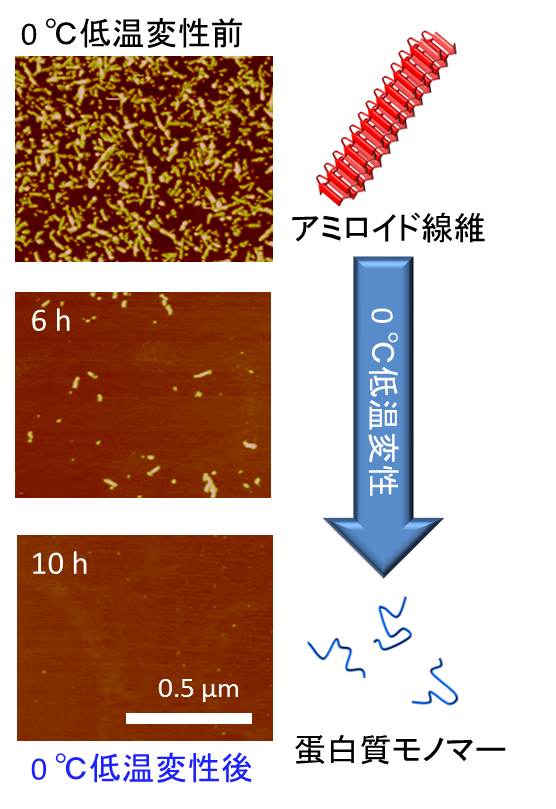
図3 αSNアミロイド線維の低温変性
αSNアミロイド線維は約10 時間で、完全に線維形成前の蛋白質モノマーに解離した。
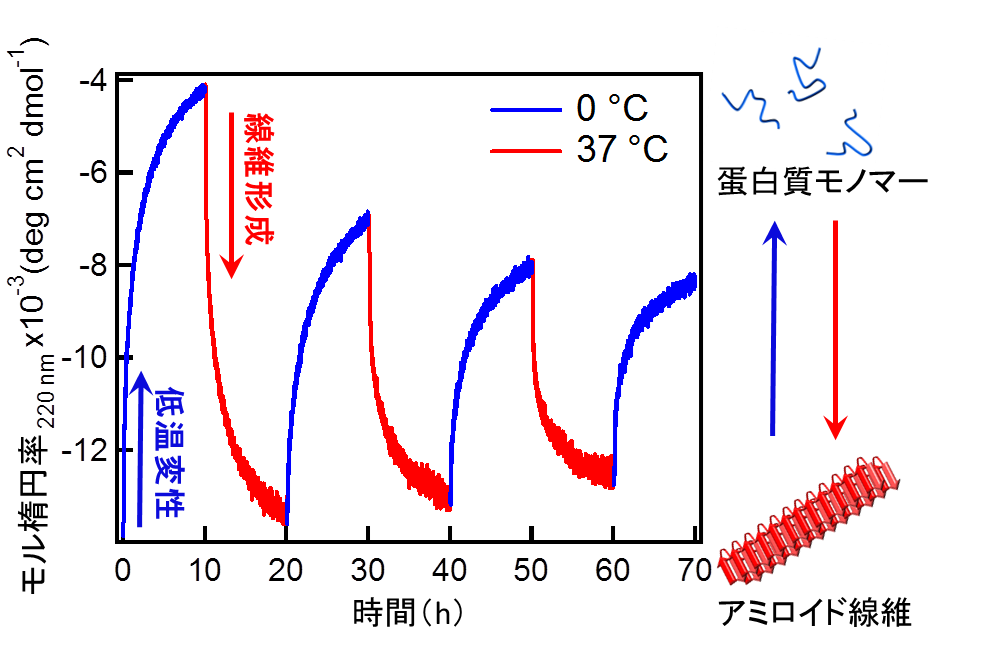
図4 αSNアミロイド線維の低温変性の可逆性
蛋白質溶液の温度を0 ℃と37 ℃で繰り返すと、それに応答して線維の変性と形成を繰り返す。
参考URL
大阪大学蛋白質研究所蛋白質構造形成研究室
http://www.protein.osaka-u.ac.jp/physical/yoeki.html
鳥取大学工学研究科蛋白質工学研究室
http://www.bio.tottori-u.ac.jp/labo/tanpakushitsukougaku.html
用語説明
- パーキンソン病
神経変性疾患の1つであり難病指定されている。主な症状は安静時の振戦 (手足のふるえ)、筋強剛 (手足の曲げ伸ばしが固くなる)、無動・動作緩慢などの運動症状だが、様々な全身症状・精神症状も合併する。進行性の病気だが症状の進み具合は通常遅いため、いつ始まったのか本人も気づかないことが多く、また経過も長い。
- 低温変性
低温にすると疎水性残基と水との親和性が増し、蛋白質内部の疎水性相互作用が弱まり、鎖状の構造になる現象である。
- 円偏光二色性
内部構造のキラルな物質が円偏光を吸収する際に左円偏光と右円偏光に対して吸光度に差が生じる現象のことである。これを利用して蛋白質の二次構造を解析することができる。アミロイド線維の特異的構造であるクロスベータ構造が検出できることから、アミロイド線維研究に幅広く用いられる。
- 原子間力顕微鏡
走査型プローブ顕微鏡の一種であり、試料と探針の原子間にはたらく力を検出して画像を得る。線維の形状だけでなく、正確な太さも解析することができる。
- αシヌクレイン
140個のアミノ酸で構成される蛋白質。末端側のアミノ酸残基多くが電荷をもち、疎水性が低い特徴的があり、生理的条件下で特定構造を持たない天然変性蛋白質である。凝集してアミロイド線維を形成すると神経細胞を破壊しパーキンソン病を引き起こす。
- 高温変性
高温にすることで蛋白質分子の揺らぎが増加し、天然構造を保てなくなるので変性する。
- 等温滴定型熱量計
等温滴定熱量測定:
一定の温度と撹拌条件下で、試料溶液に添加溶液を少量加え、それに伴う熱の出入りを測定である。本研究では、試料溶液のアミロイド線維のシードに対して単量体蛋白質を滴定し、アミロイド線維の伸長反応に伴う熱を観測した。
