阪大発のワクチンが72%のマラリア発症防御効果
熱帯熱マラリアによる死亡者の大幅な軽減が期待
リリース概要
大阪大学微生物病研究所の堀井俊宏教授は、BK-SE36マラリアワクチンの第Ib相臨床試験 をアフリカ・ウガンダにおいて実施し、マラリア高度流行地域において、72%のマラリア発症防御効果を確認しました。このワクチン効果はこれまで報告されているいかなるマラリアワクチンよりも高く、熱帯・亜熱帯地域に蔓延する熱帯熱マラリアによる死亡者の大幅な軽減が期待されます。
研究の背景
ハマダラカ (図1) によって媒介される熱帯熱マラリアは熱帯・亜熱帯において流行し (図2) 、サブサハラのアフリカ諸国を中心に年間の感染者は2億人、0-5歳の幼児を中心に犠牲者は120万人と推計されています(Lancet 2012)。また、同地域の多数の妊産婦が妊娠マラリアの危険にさらされています。
種々の抗マラリア薬に対する耐性が蔓延しており、その対策は喫緊の問題となっています。また、これまでに欧米で活発にワクチン開発研究がされてきましたが、十分な効果が得られたワクチンの報告は未だありません。その主たる理由は熱帯熱マラリア原虫が持つ巧妙な寄生戦略 によると考えられています。また、これまでに報告されたワクチン効果については、米国NIAID/NIHが開発したAMA1-C1/Alhydeogelの防御効果は0%で(Vaccine, 2009)、グラクソ・スミスクライン(GSK)が開発したRTS,S/AS01Aは31.3%に止まっています(Lancet, 2012)。
大阪大学で開発されたBK-SE36マラリアワクチン (図3) は、熱帯熱マラリア原虫のSERA遺伝子 をもとに、遺伝子組換え技術によって作製されたSE36タンパク質 と水酸化アルミニウムゲルを混合した凍結乾燥製剤で、一般財団法人阪大微生物病研究会観音寺研究所において製造されました。
2005年に日本国内で実施した第Ia相臨床試験 によってその安全性と免疫原性を確認した後、アフリカの中央部に位置するウガンダ共和国政府の承認を得て2010-2011年に同国北部のリラで第Ib相臨床試験を実施しました。リラはマラリアの高度流行地域であり、住民のほとんどは幼児期より幾度となくマラリア感染を経験しています。
マラリア感染歴のある人たちがBK-SE36ワクチンに異常な免疫反応するかどうかを調べることが、本臨床試験の大きな目的です。成人男女を対象としたステージ1で安全性を確認し、その後に6-20歳の若年層を対象としたステージ2でさらに安全性を確認しました。ステージ1のワクチン接種によってSE36タンパク質に対する抗体が誘導されるかどうかという免疫原性試験では、マラリア感染歴のない日本人とは大きく異なり、成人ではほとんどワクチンに反応がみられませんでしたが、最も若い年齢群である6-10歳では免疫応答が認められました。第Ib相臨床試験のステージ2では6-20歳のボランティア66名にBK-SE36マラリアワクチンを接種しました。これらの接種者をその後1年間にわたってマラリア感染の状況を観察した結果、ワクチンを接種しなかった対照群に比べて72%の防御効果を確認しました (図4) 。
本研究成果が社会に与える影響(本研究成果の意義)
「人類最大の敵」と呼ばれるマラリアは、熱帯・亜熱帯の開発途上国で蔓延しており、居住する人びとの健康を蝕むとともに経済にも大きな打撃を与え続けています。効果的なマラリアワクチンの開発は人類の悲願であり、日本初のマラリアワクチンは発展途上国への大きな国際貢献になるとともに、国際社会における日本のプレゼンスを大いに高めるものと期待されます。
特記事項
本研究は、文部科学省科学研究費補助金(特定領域研究「感染の成立と宿主応答の分子基盤」「感染現象のマトリックス」)、「知的クラスター創成事業」及び「地域イノベーション戦略支援プログラムグローバル型(第Ⅱ期)」、新エネルギー・産業技術総合開発機構(NEDO)「基礎研究から臨床研究への橋渡し促進技術開発プログラム」、日本学術振興会科学研究費補助金(基盤研究(A)等)等の支援を受け、また、一般財団法人阪大微生物病研究会が資金を提供し、ウガンダのリラメディカルセンター(LMC)において実施したものです。
発表論文
本研究成果は、5月28日(火)17時(米国東部時間)にオープンアクセスの雑誌PLOS ONEに掲載予定です。
論文タイトル: Phase 1b randomized trial and follow-up study in Uganda of the blood-stage malaria vaccine candidate BK-SE36 (赤血球期マラリアワクチン候補BK-SE36のウガンダにおける第Ib相臨床試験とそのフォローアップ)
参考図

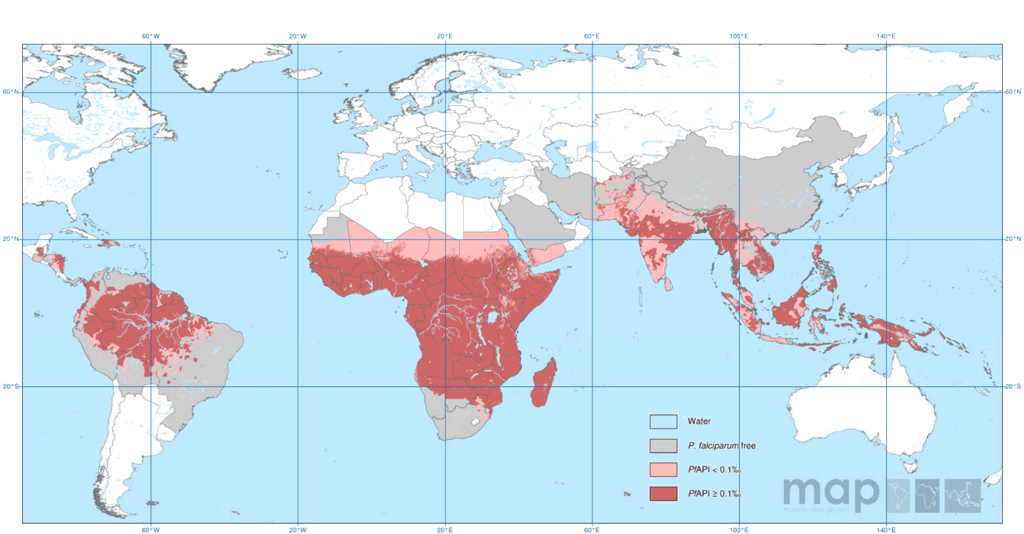
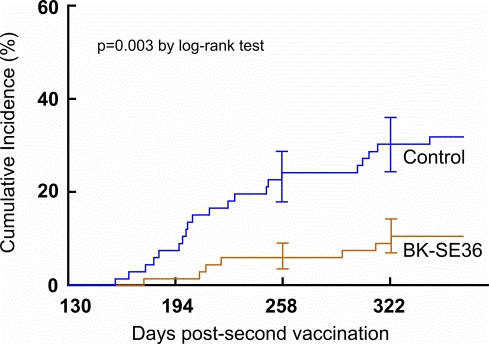
図4 カプランマイヤープロットで見るBK-SE36ワクチン接種群で72%の防御効果
参考URL
用語説明
- 相臨床試験
ワクチンを含む医薬品が市場に出るまでには、その安全性試験(第I相臨床試験)、生物学的効果試験(第II相臨床試験)、及び、実証試験(第III相臨床試験)を厳格な基準に基づいて実施しなければなりません。今回の結果は、流行地域における第Ib相臨床試験であり、防御効果はこの被験者についてワクチン接種後365日間臨床研究として観察したものです。Phase Iaは国内における安全性試験(第I相臨床試験)を、Phase Ibは流行地域における安全性試験(第I相臨床試験)を指します。
- 寄生戦略
マラリアを引き起こすマラリア原虫はヒトに効率よく感染するために、ヒトの免疫防御システムを撹乱し、且つそれから回避する種々のメカニズムを発達させています。その最も顕著な例が抗原をコードする遺伝子に見られる遺伝子多型です。ある型の抗原遺伝子を用いてワクチンを作製しても、それに反応しない型の抗原遺伝子をもつ原虫にはワクチン効果はありません。我々は全世界から採取した455種の熱帯熱マラリア原虫を解析し、SERA遺伝子では遺伝子多型が極めて低いことを証明しました。
- SERA遺伝子
SERA (Serine Repeat Antigen) 遺伝子:
熱帯熱マラリア原虫の表面抗原である SERAタンパク質の遺伝子です。SERAタンパク質は赤血球期マラリア原虫の表面に大量に存在します。その機能は未知です。
- SE36タンパク質
SERAタンパク質の前半部分に相当する36kDの分子量をもつ組換えタンパク質で、大腸菌で効率よく産生させるため、人工合成遺伝子より作製しました。
