神経細胞の個性を生む分子メカニズムを世界に先駆け解明
<リリース概要>
大阪大学大学院生命機能研究科の平山晃斉特任助教(常勤)と八木健教授らは、マウスを用いた実験により個々の神経細胞に個性が生まれる新たな分子メカニズムを解明し、このメカニズムが神経細胞の樹状突起 の発達や大脳皮質での機能的な神経回路の形成に関わる可能性を世界で初めて明らかにしました。
CTCFたんぱく質(CCCTC-binding protein)は細胞の核にあるクロマチン構造 を変換させる因子であり、このたんぱく質が神経細胞ごとにプロトカドヘリン遺伝子群をランダムに発現させることを解明しました。また、CTCFたんぱく質が欠損すると神経細胞のつくる回路に異常が生じることから、神経細胞の個性化と神経回路形成に関わる新たなメカニズムの存在が示唆されました。本研究の成果は、脳機能の基盤となる神経回路の形成に神経細胞ごとに個別に起こるクロマチン構造変換が必須であることを示唆した結果であり、ヒトの精神神経疾患の原因解明や新たな治療法の開発に役立つことが期待されます。
本研究は、自然科学研究機構生理学研究所の足澤悦子助教、吉村由美子教授、エラスムス医療センター(オランダ)のNiels Galjart博士の協力を得て行いました。
本研究成果は、平成24年7月26日正午(米国東部時間)に米国科学誌「Cell Reports」のオンライン速報版で公開されます。
追記(8月31日):この論文はCell Reports誌Volume2, Number2の表紙を飾り、掲載されました。
http://www.cell.com/cell-reports/issue?pii=S2211-1247%2812%29X0009-3
<研究の背景と経緯>
こころや高次な機能をもたらす脳には莫大な数の神経細胞があり、個々の神経細胞が秩序を保ちながら個性をもった神経活動をしていることが知られています。しかし、個々の神経細胞に個性がもたらされる仕組みについては明らかにされていませんでした。平成17年、私たちは58種類からなるクラスター型プロトカドヘリン(clustered protocadherins; Pcdh)遺伝子群 が、個々の神経細胞において異なった組み合わせでランダムに発現していることを世界に先駆けて発見しました。しかし、個々の神経細胞でのランダムな発現調節の仕組みや意義については明らかにされていませんでした。そこで本研究では、このクラスター型プロトカドヘリンが神経細胞ごとに異なった個性的な発現をする分子メカニズムの解明をめざしました。
<研究の内容>
本研究グループは、Pcdh遺伝子のゲノム上で発現調節領域 に結合し、クロマチン構造を制御するCTCFたんぱく質に注目しました。このCTCFたんぱく質を分化した神経細胞でのみ欠損させたマウスを用いて、個々の神経細胞におけるPcdh遺伝子群のランダムな発現制御を解析しました。その結果、Pcdh遺伝子群の個々の神経細胞でのランダムな発現が著しく低下していることを明らかにしました(図1、2)。また、CTCFが欠損した神経細胞ではシナプス 数が減少して、樹状突起の分岐や発達が十分に進まないことが明らかになりました(図3)。一方、形成された少数のシナプスは電気生理学的に野生型マウスと同様の反応を示しました。更に、このマウスの大脳皮質ではヒゲからの刺激に応じて形成されるバレル構造が消失しており、機能的な神経回路の形成が異常になることが明らかになりました(図4)。これらの結果は、CTCFが個々の神経細胞で異なるPcdh遺伝子を発現するために必要な制御因子であることを明らかにするとともに、クロマチン構造の制御に関わるCTCFが機能的神経回路の形成に必須であることを世界で始めて明らかにしたものです(図5)。
<今後の展開>
今回の研究成果で、神経細胞の個性化に関わる分子メカニズムの存在が明らかになったことより、脳における神経細胞の個性化の解析が急速に進展することが予想されます。これまでは、脳における複雑な神経回路を捉えることが困難でしたが、個々の神経細胞における神経回路形成をもたらす仕組みが明らかになることで、複雑な神経回路形成の基本原理を明らかにできると思われます。
クロマチン構造の制御が個々の神経細胞ごとに異なっておこり、機能的な神経回路形成に関わるという発見は、これまでにない新たな発見であり、全く新しい研究分野の発展を促すことが予想されます。クロマチン構造の形成や破綻が脳の正常な機能発達や精神神経疾患に関わることが示唆されてきており、これまで不明であった精神神経疾患のメカニズム解明や新たな治療薬の開発につながることが期待できます。
<参考図>
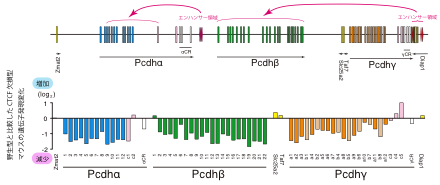
図1:CTCF欠損マウスでは、クラスター型Pcdhの発現が顕著に低下
下図は、クラスター型Pcdhの遺伝子構造を示しています。Pcdh-α、-β、-γの3つ遺伝子クラスターがあり、合計58種類の異なるたんぱく質を発現します。Pcdh-αと-βクラスターは、これまでの研究によりエンハンサー領域が見つかっており、CTCFが結合します。下図は、上図で示した各遺伝子の発現変化を表しています。クラスター型Pcdh遺伝子のうちランダムな発現を示す遺伝子の発現低下が顕著に認められました。

図2:CTCF欠損マウスにおけるクラスター型Pcdhの発現
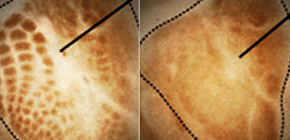
左側は大脳皮質の写真で、CTCFたんぱく質を発現している細胞が赤く染まっています。野生型マウスでは全ての細胞が赤く染まるのに対し、CTCFを一部の神経細胞でのみ欠損したマウスでは赤く染まる細胞が少なくなっています。右側の図は、クラスター型Pcdhの発現の一例としてPcdh-α4の遺伝子発現を示しています。CTCF欠損型マウスでは、Pcdh-α4を発現している細胞が野生型マウスと比較して著しく減少しています。これは、CTCFが欠損した神経細胞でPcdh-α4の発現が認められない程に低下したことを示しています。

図3:CTCF欠損マウスの神経細胞では樹状突起の発達に異常
左図は、神経細胞の電気的活動として、NMDA及びAMPA受容体を介した興奮性シナプス応答を解析した結果を示しています。野生型とCTCF欠損型で差は認められませんでした。CTCFが欠損した神経細胞において形成される少数のシナプスは野生型と同様に成熟していることを示しています。右図は、神経細胞の形をトレースした結果です。生後7日目では野生型とCTCF欠損型とで神経細胞の形に明らかな差は認められませんでした。一方、生後14日目になると野生型と比較して、CTCF欠損型では樹状突起の枝分かれの数が減少していました。
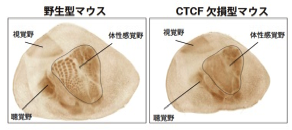
図4:マウスのヒゲの並びに対応した大脳皮質体性感覚野のバレル構造が消失
マウス大脳皮質の体性感覚野には、バレル構造と呼ばれる樽状の構造が、生後のヒゲからの刺激を受けることではじめて形成されます(左側の図)。一方、CTCF欠損マウスでは、バレル構造が認められませんでした(右側の図)。視覚野や聴覚野といった脳の領野は野生型と同様に認められました。
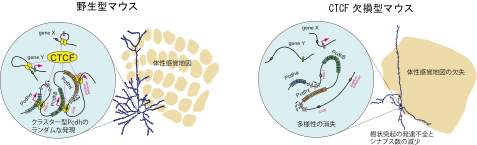
図5:まとめ
本研究により、CTCFがクラスター型Pcdhのランダムな遺伝子発現に働く重要な因子であることが分かりました。また、CTCFが樹状突起の発達やシナプスの形成、刺激依存的な神経回路形成に重要であることを明らかにしました。
<論文タイトル>
“CTCF is required for neural development and stochastic expression of clustered Pcdh genes in neurons”
(日本語タイトル CTCFは神経回路の発達と神経細胞におけるクラスター型プロトカドヘリンの確率的な発現に必要である。)
<参考URL>
用語説明
- 樹状突起
神経細胞から伸びた枝状の突起。多数の神経細胞からの入力を受けることで複雑な神経回路形成を担う。
- クロマチン構造
DNAとたんぱく質の複合体。DNAはヒストンたんぱく質に巻き付いてコンパクトに折り畳まれている。また、DNA上の遠くは離れた場所同が、たんぱく質を介して結合することで複雑な高次クロマチン構造を形成し、遺伝子発現に大きく影響する。
- クラスター型プロトカドヘリン(clustered protocadherins; Pcdh)遺伝子群
細胞と細胞との結合に働く分子群の1グループ。脊椎動物でのみ認められ、中枢神経系で強い発現を示す。よく似た遺伝子が同じ染色体上にクラスター状に並んだ特徴的な遺伝子構造をしている。
- 発現調節領域
DNA上にある遺伝子の発現を調節する領域。その位置は、遺伝子の近傍にあったり、遠くはなれたところにあったりと様々である。領域により遺伝子の発現を増加させたり抑えたりする。
- シナプス
神経細胞同士の接合部にできる構造。神経細胞間の情報伝達をおこなう。
